Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Fe}=\dfrac{33.6}{56}=0.6\left(mol\right)\)
\(Fe_2O_3+3H_2\underrightarrow{^{^{t^0}}}2Fe+3H_2O\)
\(0.3..........0.9......0.6\)
\(m_{Fe_2O_3}=0.3\cdot160=48\left(g\right)\)
\(V_{H_2}=0.9\cdot22.4=20.16\left(l\right)\)

\(m_{Cu}=12g\Rightarrow n_{Cu}=\dfrac{12}{64}=0,1875mol\)
\(\Rightarrow m_{Fe}=m_{kl}-m_{Cu}=24-12=12g\Rightarrow n_{Fe}=\dfrac{3}{14}mol\)
\(CuO+H_2\rightarrow Cu+H_2O\)
\(\dfrac{12}{64}\) \(\dfrac{12}{64}\)
\(Fe_2O_3+3H_2\rightarrow2Fe+3H_2O\)
\(\dfrac{9}{28}\) \(\dfrac{3}{14}\)
\(\Rightarrow\Sigma n_{H_2}=\dfrac{12}{64}+\dfrac{9}{28}=\dfrac{57}{112}mol\)
\(\Rightarrow V_{H_2}=\dfrac{57}{112}\cdot22,4=11,4l\)

a) Fe2O3 + 3H2 --to--> 2Fe + 3H2O
b) \(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
PTHH: Fe2O3 + 3H2 --to--> 2Fe + 3H2O
0,1<---0,3<-----0,2
=> mFe2O3 = 0,1.160 = 16 (g)
c) VH2 = 0,3.22,4 = 6,72 (l)

Ta có: \(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
a, PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
______0,2_________________0,2 (mol)
b, VH2 = 0,2.22,4 = 4,48 (l)
c, Ta có: \(n_{FeO}=\dfrac{7,2}{72}=0,1\left(mol\right)\)
PT: \(FeO+H_2\underrightarrow{t^o}Fe+H_2O\)
Xét tỉ lệ: \(\dfrac{0,1}{1}< \dfrac{0,2}{1}\), ta được H2 dư.
Theo PT: \(n_{Fe}=n_{FeO}=0,1\left(mol\right)\)
⇒ mFe = 0,1.56 = 5,6 (g)
Bạn tham khảo nhé!
a) Zn + 2HCl \(\rightarrow\)ZnCl2 + H2
b) mZn = \(\dfrac{13}{65}\)=0,2 (mol)
Zn + 2HCl \(\rightarrow\)ZnCl2 + H2
(mol) 0,2 ----------------------> 0,2
\(V_{H_2}\)= 0,2 . 22,4 = 4,48(lít)
c)\(n_{FeO}\)=\(\dfrac{7,2}{72}\)=0,1 (mol)
H2 + FeO \(\underrightarrow{t^o}\)Fe + H2O
(mol) 0,1----->0,1
mFe = 0,1 . 56 = 5,6(g)

\(CT:Fe_xO_y\)
\(Fe_xO_y+yH_2\underrightarrow{^{t^o}}xFe+yH_2O\left(1\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\left(2\right)\)
\(n_{Fe}=n_{H_2\left(2\right)}=\dfrac{4.032}{22.4}=0.18\left(mol\right)\)
\(n_{H_2\left(1\right)}=\dfrac{y}{x}\cdot n_{Fe}=\dfrac{5.376}{22.4}=0.24\left(mol\right)\)
\(\Leftrightarrow\dfrac{y}{x}\cdot0.18=0.24\)
\(\Leftrightarrow\dfrac{x}{y}=\dfrac{3}{4}\)
\(CT:Fe_3O_4\)
\(m_{Fe_3O_4}=\dfrac{0.18}{3}\cdot232=13.92\left(g\right)\)

a) \(3Fe+2O_2-^{t^o}\rightarrow Fe_3O_4\)
b) \(n_{Fe}=0,3\left(mol\right);n_{O_2}=0,2\left(mol\right)\)
Lập tỉ lệ : \(\dfrac{0,3}{3}=\dfrac{0,2}{2}\) => Cả 2 chất đều phản ứng hết
=> \(m_{O_2}=0,2.32=6,4\left(g\right)\)
c)Cách 1 :
Bảo toàn khối lượng => \(m_{Fe_3O_4}=m_{Fe}+m_{O_2}=16,8+6,4=23,2\left(g\right)\)
Cách 2: \(n_{Fe_3O_4}=\dfrac{1}{3}n_{Fe}=0,1\left(mol\right)\)
=> \(m_{Fe_3O_4}=0,1.232=23,2\left(g\right)\)

nFe=0,2(mol)
a) PTHH: Fe2O3 + 3 H2 -to-> 2 Fe + 3 H2O
0,1_____________0,3____0,2(mol)
b) mFe2O3=160.0,1=16(g)
c) V(H2,đktc)=0,3.22,4=6,72(l)
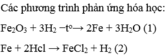
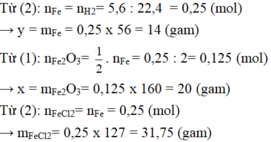

a) Gọi CTHH của oxit sắt là FexOy (x,y nguyên dương)
\(Fe_xO_y+yH_2\xrightarrow[]{t^o}xFe+yH_2O\)
b) \(n_{H_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
Theo PT: \(n_{Fe_xO_y}=\dfrac{1}{y}.n_{H_2}=\dfrac{0,4}{y}\left(mol\right)\)
\(\Rightarrow M_{Fe_xO_y}=\dfrac{23,2}{\dfrac{0,4}{y}}=58y\left(g/mol\right)\)
\(\Rightarrow56x+16y=58y\\ \Leftrightarrow\dfrac{x}{y}=\dfrac{3}{4}\)
Vậy CTHH của oxi sắt là Fe3O4