Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
b, \(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
Theo PT: \(n_{Fe_2O_3}=\dfrac{1}{2}n_{Fe}=0,1\left(mol\right)\Rightarrow m_{Fe_2O_3}=0,1.160=16\left(g\right)\)
c, Theo PT: \(n_{H_2}=\dfrac{3}{2}n_{Fe}=0,3\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,3.22,4=6,72\left(l\right)\)

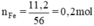
Phương trình hóa học của phản ứng:
Fe2O3 + 3H2 → 2Fe + 3H2O.
Khử 1 mol Fe2O3 cho 2 mol Fe.
x mol Fe2O3 → 0,2 mol.
x = 0,2 : 2 =0,1 mol.
m = 0,1 .160 =16g.
Khử 1 mol Fe2O3 cần 3 mol H2.
Vậy khử 0,1 mol Fe2O3 cần 0,3 mol H2.
V= 0,3 .22.4 = 6,72l.

Fe2O3+3H2-to>2Fe+3H2O
0,1125---0,3375----0,225 mol
n Fe=0,225 mol
=>m Fe2O3=0,1125.160=18g
=>VH2=0,3375.22,4=7,56l

nFe=0,2(mol)
a) PTHH: Fe2O3 + 3 H2 -to-> 2 Fe + 3 H2O
0,1_____________0,3____0,2(mol)
b) mFe2O3=160.0,1=16(g)
c) V(H2,đktc)=0,3.22,4=6,72(l)

a, \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
b, \(n_{Fe}=\dfrac{24}{56}=\dfrac{3}{7}\left(mol\right)\)
Theo PT: \(n_{Fe_2O_3}=\dfrac{1}{2}n_{Fe}=\dfrac{3}{14}\left(mol\right)\Rightarrow m_{Fe_2O_3}=\dfrac{3}{14}.160=\dfrac{240}{7}\left(g\right)\)
c, Theo PT: \(n_{H_2}=\dfrac{3}{2}n_{Fe}=\dfrac{9}{14}\left(mol\right)\Rightarrow V_{H_2}=\dfrac{9}{14}.22,4=14,4\left(l\right)\)
\(n_{Fe}=\dfrac{m}{M}=\dfrac{24}{56}\approx0,43\left(mol\right)\\ a.PTHH:Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
2 3 2 3
0,43 0,645 0,45 0,645
\(b.m_{Fe_2O_3}=n.M=0,43.\left(56.2+16.3\right)=68,8\left(g\right)\\ c.V_{H_2}=n.24,79=0,645.24,79=15,98955\left(l\right).\)

Số mol của sắt
nFe = \(\dfrac{m_{Fe}}{M_{Fe}}=\dfrac{11,2}{56}=0,2\) (mol)
Pt : Fe2O3 + 3H2 \(\rightarrow\) 2Fe + 3H2O\(|\)
1 2 2 2
0,1 0,2
Số mol của sắt (III) oxit
nFe2O3 = \(\dfrac{0,2.1}{2}=0,1\) (mol)
Khối lượng của sắt (III) oxit
mFe2O3 = nFe2O3 . MFe2O3
= 0,1 . 160
= 16 (g)
Chúc bạn học tốt
Bạn sửa lại số ghi dưới phương trình của cân bằng khí hidro và nước giúp mình

2)
nH2 = 6.72/22.4 = 0.3 (mol)
Fe2O3 + 3H2 -to-> 2Fe + 3H2O
0.1______0.3______0.2
mFe2O3 = 0.1*160 = 16 (g)
mFe = 0.2*56 = 11.2 (g)
3)
nFe3O4 = 11.6/232 = 0.05 (mol)
3Fe + 2O2 -to-> Fe3O4
0.15___0.1______0.05
mFe = 0.15*56 = 8.4 (g)
VO2 = 0.1*22.4 = 2.24 (l)
2KClO3 -to-> 2KCl + 3O2
1/15______________0.1
mKClO3 = 1/15 * 122.5 = 8.167 (g)
a)
3H2 + Fe2O3 --to--> 2Fe + 3H2O
b) nH2 = 6,72/22,4 = 0,3 mol
Từ pt => nFe3O4 = 0,1 mol
=> mFe3O4 = 0,1. 232 = 23,2 g



a) Fe2O3 + 3H2 --to--> 2Fe + 3H2O
b) \(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
PTHH: Fe2O3 + 3H2 --to--> 2Fe + 3H2O
0,1<---0,3<-----0,2
=> mFe2O3 = 0,1.160 = 16 (g)
c) VH2 = 0,3.22,4 = 6,72 (l)