Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Sau phản ứng, \(V_{dd}= V_1 + V_2(lít)\)
Ta có : [H+] = 10-3 ⇒ \(n_{H_2SO_4} = 5.10^{-4}V_1(mol)\)
Lại có: \(n_{NaOH} = V_2.\dfrac{10^{-14}}{10^{-12}} = 0,01V_2(mol)\)
pH = 4 < 7 Chứng tỏ axit dư
2NaOH + H2SO4 → Na2SO4 + 2H2O
0,01V2.......5.10-3V2..................................(mol)
Suy ra : \(\dfrac{5.10^{-4}V_1-5.10^{-3}V_2}{V_1+V_2}.2 = 10^{-4}\\ \Rightarrow \dfrac{V_1}{V_2} = \dfrac{101}{9}\)
Đáp án B

Trường hợp 1: Khi nhỏ từ từ axit vào dung dịch muối cacbonat, phản ứng xảy ra theo trình từ
H+ + CO32- → HCO3-
Sau đó H+còn dư + HCO3- → CO2 + H2O
→ nCO2 = nH+ – nCO32- = 0,1(x – y)
Trường hợp 2: Khi nhỏ từ từ muối cacbonat vào axit thì phản ứng tạo ra ngay CO2:
2H+ + CO32- → CO2 + H2O
nCO2 = ½ nH+ = 0,05x
Do V1 : V2 = 4 : 7
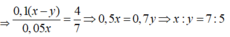
Đáp án C

Đây chỉ là một bài toán về kim loại Cu tác dụng với dung dịch có chứa NO3- và H+ đơn giản.
Để giải quyết bài này ta chỉ cần sử dụng đến phương trình ion thu gọn để giải quyết.
Thí nghiệm 1: ta có:
![]()
Xét phản ứng: 3Cu + 2NO3- + 8H+ → 3 C u 2 + +2NO + 4 H 2 O
Ban đầu: 0,12 (mol) 0,16 0,16
Phản ứng: 0,06 0,04 0,16 0,04
Sau phản ứng: 0,06 0,12 0 0,04
Thí nghiệm 2: ta có:
![]()
Xét phản ứng: 3Cu + 2 N O - 3 + 8 H + → 3 C u 2 + + 2NO + 4 H 2 O
Ban đầu: 0,12 (mol) 0,16 0,32
Phản ứng: 0,12 0,08 0,32 0,08
Sau phản ứng: 0 0,08 0 0,08
Ta thấy:
![]()
Đáp án C.
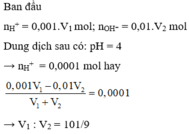
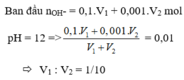
Đáp án A
nH+ = 0,04V1 (mol); nOH-= 0,035V2 (mol)
H++ OH- → H2O
Dung dịch sau phản ứng có pH = 2 nên axit dư
nH+ dư = 0,04V1- 0,035V2
[H+]dư = nH+ dư/ Vdd = (0,04V1- 0,035V2)/(V1+ V2) = 10-2
Suy ra V1/V2 = 3/2