Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Sau phản ứng, \(V_{dd}= V_1 + V_2(lít)\)
Ta có : [H+] = 10-3 ⇒ \(n_{H_2SO_4} = 5.10^{-4}V_1(mol)\)
Lại có: \(n_{NaOH} = V_2.\dfrac{10^{-14}}{10^{-12}} = 0,01V_2(mol)\)
pH = 4 < 7 Chứng tỏ axit dư
2NaOH + H2SO4 → Na2SO4 + 2H2O
0,01V2.......5.10-3V2..................................(mol)
Suy ra : \(\dfrac{5.10^{-4}V_1-5.10^{-3}V_2}{V_1+V_2}.2 = 10^{-4}\\ \Rightarrow \dfrac{V_1}{V_2} = \dfrac{101}{9}\)
Đáp án B

Chọn đáp án D
Chú ý : PH=2 suy ra nồng độ H+ là 0,01.Nhiều bạn sẽ cho môi trường là trung tính ngay.Nhưng các bạn chú ý nhé .HCOOH không điện ly hoàn toàn sau khi H+ đã điện ly phản ứng hết với NaOH nó lại tiếp tục điện ly ra H+ do đó môi trường sẽ là axit

Giải thích các bước giải:
pH = 9 → [H+] = 10−9(M)
[H+].[OH-]=10−14
→ [OH-] = 10−5(M)
→ nOH- = 10−5 . 1 = 10−5(mol)
pH=8 → [H+] = 10−8(M)
[H+].[OH-]=10−14
→ [OH-] = 10−6(M)
Gọi x lít là thể tích nước cần dùng
Ta có
\(\dfrac{10^{-5}}{x+1}\)= 10-6
→x=9
Chọn câu C.9 lít

Câu 1 :
Gọi thể tích dung dịch ban đầu là V(lít)
$[H^+] = 10^{-3}V(mol)$
Thể tích dung dịch lúc sau là :
$V' = \dfrac{10^{-3}.V}{10^{-4}} = 10V$
Do đó cần pha loãng dung dịch ban đầu 10 lần thì thu được dung dịch trên

Đáp án B
nH+ ban đầu = 0,1.2.0,1 + 0,2.0,1 + 0,3.0,1 = 0,07
dung dịch C có pH=1 ⇒ nH+/C = 0,1.(0,3 + V)
⇒ nH+ ban đầu = nH+/C + nOH- ⇒ 0,07 = 0,1.(0,3 + V) + 0,2V +0,1.2V
⇒ V =0,08l

\(pH=2\Rightarrow\left[H^+_{dư}\right]=10^{-2}\Rightarrow n_{H^+}=10^{-2}\left(V+0,4\right)\)
\(n_{H^+}=2.0,0375.0,4+0,0125.0,4=0,035\left(mol\right)\)
\(n_{OH^-}=0,3V\left(mol\right)\)
\(\Rightarrow0,035+0,3V=10^{-2}\left(V+0,4\right)\)
\(\Rightarrow V=33,1\left(l\right)\)
\(\Leftrightarrow V=\)

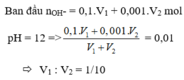
Đáp án B