Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi số mol CuSO4.5H2O cần lấy là x (mol) => nCuSO4 = x (mol)
Khối lượng CuSO4 2% có trong 400 gam dung dịch là:
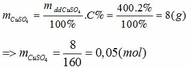
Tổng số mol CuSO4 sau khi hòa tan là: x + 0,05 (mol)
=> thể tích dung dịch sau khi hòa tan:

Từ (1) và (2)
=> (x+ 0,05).1000
=> 1100x + 55 = 160x + 400
=> 850x = 345
=> x ≈0, 406 (mol)
=> mCuSO4.5H2O = 0,406.250 = 101,47 (g)

Câu a)
\(m_{ddCuSO_4\left(10\%\right)}=400.1,1=440\left(g\right)\\ m_{CuSO_4\left(dd.10\%\right)}=10\%.440=44\left(g\right)\\ C\%_{ddCuSO_4\left(cuối\right)}=20,8\%\\ \Leftrightarrow\dfrac{m_{CuSO_4}+44}{440+m_{CuSO_4}}.100\%=20,8\%\\ \Leftrightarrow m_{CuSO_4}=60\left(g\right)\)
Vậy: Cần lấy 60 gam CuSO4 hoà tan vào 400 ml dung dịch CuSO4 10% (D=1,1g/ml) để tạo dung dịch C có nồng độ 20,8%
Câu b em xem link này he https://hoc24.vn/cau-hoi/acan-lay-bao-nhieu-g-cuso4-hoa-tan-vao-400ml-dd-cuso4-10d11gml-de-tao-thanh-dd-c-co-nong-do-288-b-khi-ha-nhiet-do-dd-c-xuong-12doc-thi-th.224557369474

Gọi m là khối lượng CuSO4.5H2O cần dùng.
Khối lượng CuSO4 có trong CuSO4.5H2O là m.160/(160 + 18.5) = 0,64m
Khối lượng CuSO4 có trong 200g dung dịch CuSO4 4% là 200/0,04 = 8(g)
Dung dịch thu được có mCuSO4 = 0,64m + 8
mdd = m + 200
Nồng độ dung dịch là 14% ⇒ (0,64m + 8)/(m + 200) = 0,14
⇒ m = 40
cho mk hỏi gọi m là khối lượng của CuSO4.5H2O mà sao khi tìm khối lượng cuso4 có trg tt là lấy m.160/(160+18.5)

a)
$Fe + CuSO_4 \to FeSO_4 + Cu$
Theo PTHH : $n_{Cu} = n_{CuSO_4} = 0,3.1 = 0,3(mol)$
$m_{Cu} = 0,3.64 = 19,2(gam)$
b) $n_{FeSO_4} = n_{CuSO_4} = 0,3(mol)$
$\Rightarrow m_{FeSO_4} = 0,3.152 = 45,6(gam)$
c) $FeSO_4 + 2NaOH \to Fe(OH)_2 + Na_2SO_4$
$n_{Fe(OH)_2} = n_{FeSO_4} = 0,3(mol)$
$m_{Fe(OH)_2} = 0,3.90 = 27(gam)$

\(Đặt:n_{Fe}=a\left(mol\right);n_{Al}=b\left(mol\right)\left(a,b>0\right)\\ Kim.loại.còn.lại.sau.p.ứ:Cu\\ n_{Cu}=\dfrac{25,4}{64}=0,4\left(mol\right)\\ a,PTHH:Fe+CuSO_4\rightarrow FeSO_4+Cu\\ 2Al+3CuSO_4\rightarrow Al_2\left(SO_4\right)_3+3Cu\\ \Rightarrow\left\{{}\begin{matrix}56a+27b=11\\a+1,5b=0,4\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,2\end{matrix}\right.\\b, \%m_{Fe}=\dfrac{0,1.56}{11}.100\approx50,909\%\\ \%m_{Cu}\approx100\%-50,909\%\approx49,091\%\\ c,V_{ddsau}=V_{ddCuSO_4}=0,2\left(l\right)\\ C_{MddFeSO_4}=\dfrac{0,1}{0,2}=0,5\left(M\right);C_{MddAl_2\left(SO_4\right)_3}=\dfrac{0,2:2}{0,2}=0,5\left(M\right)\\ d,C_{MddCuSO_4}=\dfrac{a+1,5b}{0,2}=2\left(M\right)\)

=> nCuSO4 = 2,5160 = 0,015625 ( mol)
mH2O = 50 - 2,5 = 47,5(g)
- Học sinh A: khi làm bay hơi phân nửa lượng nước thì:
mH2O bị loại = 47,52 = 23,75(g)
mdd sau = 50 - 23,75 = 26,25(g)
C = 2,526,25 . 100% = 9,52% ( sai)
- Học sinh B: khi cho thêm 2,78g CuSO4 khan vào dung dịch thì :
mCuSO4 = 2,5 + 2,78 = 5,28 (g)
mdd = 50 + 2,78 = 52,78(g)
C = 5,2852,78 . 100% = 10% ( đúng)
- Học sinh C: khi thêm 4,63g tinh thể CuSO4.5H2O vào dung dịch thì :
mCuSO4 thêm vào = 160.4,63250 = 2,9632(g)
mCuSO4 sau = 2,5 + 2,9632 = 5,4632(g)
mdd CuSO4 = 50 + 4,63 = 54,63(g)
C = 5,463254,63 . 100% = 10% ( đúng)
- Học sinh D: khi thêm 50g dung dịch CuSO4 15% vào dung dịch thì:
mCuSO4 thêm vào = 50.15100 = 7,5(g)
mCuSO4 sau = 2,5 + 7,5 = 10(g)
mdd CuSO4 = 50 + 50 = 100 (g)
C = 10100 . 100% = 10% ( đúng)
=> các học sinh B, C và D làm đúng.

\(Đặt:m_{CuSO_4\left(thêm\right)}=a\left(g\right)\\ V_{ddCuSO_4\left(sau\right)}=\dfrac{a+160}{1,25}\\ C_{MddCuSO_4\left(sau\right)}=1\left(M\right)\\ \Leftrightarrow\dfrac{\dfrac{a+160.5\%}{160}}{\dfrac{a+160}{1,25.1000}}=1\\ \Leftrightarrow a=14,312\left(g\right)\\ \Rightarrow m_{CuSO_4\left(thêm\right)}=14,312\left(g\right)\)