Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

mdd HNO3 500ml=500.1,2=600(g)
mHNO3=600.20%=150(g)
C% dd HNO3 mới=\(\dfrac{150}{300}.100\%=50\%\)

Ta có: mddHNO3(ban đầu)= 500. 1,20=600(g)
=> mHNO3= 20%. 600=120(g)
=> C%ddHNO3(sau)= (120/300).100 = 40%

Gọi x(g) là khối lượng của nước bay hơi khỏi dung dịch để có dung dịch NaOH 8%.
Ta có công thức:
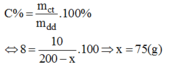
Vậy cho 75g nước bay hơi ra khỏi 200g dung dịch NaOH ban đầu, ta có: 200 – 75 = 125(g) dung dịch NaOH 8%.

Câu 1 :
Ta có : \(20\%=\dfrac{m_{ct}}{m_{dd}}.100\%\left(I\right)\)
Mà : \(25\%=\dfrac{m_{ct}}{m_{dd}-75}.100\%\left(II\right)\)
- Giair hệ phương trình ( I ) và ( II ) ta được : \(m_{dd}=375\left(g\right)\)

\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\\ n_{H_2SO_4}=n_{H_2}=\dfrac{1,568}{22,4}=0,07\left(mol\right)\\ n_{H_2SO_4\left(ban.đầu\right)}=5.0,3=1,5\left(mol\right)\\ V_{ddH_2SO_4\left(lấy\right)}=\dfrac{0,07}{1,5}.3=0,14\left(l\right)=140\left(ml\right)\)

Câu 6:
\(m_{dd.bđ}=1,1.200=220\left(g\right)\)
\(n_{FeSO_4.7H_2O}=\dfrac{83,4}{278}=0,3\left(mol\right)\Rightarrow n_{FeSO_4}=0,3\left(mol\right)\)
=> \(C\%_{dd.bđ}=\dfrac{0,3.152}{220}.100\%=20,73\%\)
Câu 7:
\(m_{MgCl_2\left(dd.ở.60^oC\right)}=\dfrac{500.37,5}{100}=187,5\left(g\right)\)
=> \(m_{H_2O}=500-187,5=312,5\left(g\right)\)
Giả sử có a mol MgCl2.6H2O tách ra
\(n_{MgCl_2\left(dd.ở.10^oC\right)}=\dfrac{187,5}{95}-a=\dfrac{75}{38}-a\left(mol\right)\)
=> \(m_{MgCl_2\left(dd.ở.10^oC\right)}=95\left(\dfrac{75}{38}-a\right)=187,5-95a\left(g\right)\)
\(n_{H_2O\left(tách.ra\right)}=6a\left(mol\right)\)
\(m_{H_2O\left(dd.ở.10^oC\right)}=312,5-18.6a\)=312,5 - 108a (g)
=> \(S_{10^oC}=\dfrac{187,5-95a}{312,5-108a}.100=53\left(g\right)\)
=> \(a=\dfrac{4375}{7552}\left(mol\right)\)
=> \(m_{MgCl_2.6H_2O}=\dfrac{4375}{7552}.203=117,6\left(g\right)\)

mdd HNO3 = 500x1,2= 600g
=> mHNO3=\(\dfrac{m\text{dd}.C\%}{100\%}\)= \(\dfrac{600.20\%}{100\%}\)=120g
C% dd lúc sau= \(\dfrac{120}{200}\).100%=60%