Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

- Pư với O2:
\(4P+5O_2\underrightarrow{t^o}2P_2O_5\)
\(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
\(CH_4+2O_2\underrightarrow{t^o}CO_2+2H_2O\)
\(CO+\dfrac{1}{2}O_2\underrightarrow{t^o}CO_2\)
\(SO_2+\dfrac{1}{2}O_2\underrightarrow{t^o,V_2O_5}SO_3\)
\(Ba+\dfrac{1}{2}O_2\underrightarrow{t^o}BaO\)
- Pư với H2:
\(CuO+H_2\underrightarrow{^o}Cu+H_2O\)
- Pư với H2O:
\(Na_2O+H_2O\rightarrow2NaOH\)
\(SO_2+H_2O⇌H_2SO_3\)
\(Ba+2H_2O\rightarrow Ba\left(OH\right)_2+H_2\)
chất tác dụn với O2
\(2SO_2+O_2\xrightarrow[]{}2SO_3\)
\(4P+5O_2\underrightarrow{t^o}2P_2O_5\)
\(4Al+3O_2\xrightarrow[]{}2Al_2O_3\)
\(CH_4+2O_2\xrightarrow[]{}CO_2+2H_2O\)
\(2CO+O_2\xrightarrow[]{}2CO_2\)
tác dụng với H2
\(CuO+H_2\xrightarrow[]{}Cu+H_2O\)
\(Al_2O_3+3H_2\xrightarrow[]{}2Al+3H_2O\)
\(Na_2O+H_2\xrightarrow[]{}2Na+H_2O\)
tác dụng với H2O
\(2Al+3H_2O\xrightarrow[]{}Al_2O_3+3H_2\)
\(Ba+2H_2O\xrightarrow[]{}Ba\left(OH\right)_2+H_2\)

C O 2 : được tạo ra từ đơn chất cacbon và oxi.
S O 2 : được tạo ra từ đơn chất lưu huỳnh và oxi.
P 2 O 5 : được tạo ra từ đơn chất photpho và oxi.
A l 2 O 3 : được tạo ra từ đơn chất nhôm và oxi.
F e 3 O 4 : được tạo ra từ đơn chất sắt và oxi.

\(PTHH:C+O_2\underrightarrow{t^0}CO_2\)
\(S+O_2\underrightarrow{t^o}SO_2\)
\(4P+5O_2\underrightarrow{t^o}2P_2O_5\)
\(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
\(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
\(2H_2+O_2\underrightarrow{t^o}2H_2O\)
\(4K+O_2\rightarrow2K_2O\)
\(Cu+O_2\underrightarrow{t^o}CuO\)

a) được tạo từ các đơn chất C,P,Al, Cu với O
b) \(C+O2--to->CO2\)
\(4P+5O2--to-->2P2O5\)
\(4Al+3O2-->2Al2O3\)
\(2Cu+O2-->2CuO\)

- Các oxit tác dụng với nước: SO2, Na2O, CaO, P2O5, CO2
SO2 + H2O --> H2SO3
Na2O + H2O --> 2NaOH
CaO + H2O --> Ca(OH)2
P2O5 + 3H2O --> 2H3PO4
CO2 + H2O --> H2CO3

Câu 7
\(a.Na+H_2O\xrightarrow[]{}NaOH+H_2\\ K_2O+H_2O\xrightarrow[]{}2KOH\\ SO_2+H_2O\xrightarrow[]{}H_2SO_3\\ P_2O_5+3H_2O\xrightarrow[]{}2H_3PO_4\)
\(b.Fe_2O_3+3H_2\xrightarrow[t^0]{}2Fe+3H_2O\\ HgO+H_2\xrightarrow[]{t^0}Hg+H_2O\\ CuO+H_2\xrightarrow[]{t^0}Cu+H_2O\\ PbO+H_2\xrightarrow[]{t^0}Pb+H_2O\)
Câu 8
\(\left(1\right)2KClO_3\xrightarrow[]{t^0}2KCl+3O_2\)(tác dụng nhiệt, xúc tác)
\(\left(2\right)Al+H_2SO_4\xrightarrow[]{}Al_2\left(SO_4\right)_3+H_2\)(nhiệt độ phòng)
-(1)Phản ứng phân huỷ.
-(2)Phản ứng thế.
-(1)Điều chế khí \(O_2\) trong phòng thí nghiệm.
-(2)Điều chế \(H_2\) trong phòng thí nghiệm
Câu 8 PTHH 2 đã Cân bằng hoá học chưa, Câu 7a PTHH 1 cũng rứa

a) Ví dụ: 2 Na + 1/2 O2 → Na2O (kim loại Na oxi hóa tạo thành oxit bazơ Na2O)
b) Ví dụ: S + 3 O2 → SO3 (phi kim S oxi hóa tạo thành oxit axit SO3)
c) Ví dụ: 4 Fe + 3 O2 → 2 Fe2O3 (hợp chất Fe oxi hóa tạo thành oxit bazơ Fe2O3)
d) Ví dụ: Mg + 2 HCl → MgCl2 + H2 (kim loại Mg tác dụng với axit HCl để điều chế khí hiđro H2)
e) Ví dụ: CaO + H2O → Ca(OH)2 (oxit bazơ CaO tác dụng với nước H2O tạo thành bazơ Ca(OH)2)
f) Ví dụ: SO3 + H2O → H2SO4 (oxit axit SO3 tác dụng với nước H2O tạo thành axit H2SO4)
g) Ví dụ: 2 Na + 2 H2O → 2 NaOH + H2 (kim loại Na tác dụng với nước H2O tạo thành bazơ NaOH và khí hiđro H2)
h) Ví dụ: CuO + CO → Cu + CO2 (cacbon(II)oxit CO khử oxi hóa oxit bazơ CuO tạo thành kim loại Cu và oxit khí CO2)
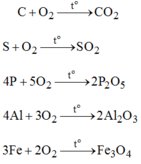
3Fe+2O2-to>Fe3O4
4Al+3O2-to>2Al2O3
2Cu+O2-to>2CuO
4P+5O2-to>2P2O5
2H2+O2-to>2H2O
S+O2-to>SO2