Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Phương trình hóa học biểu diễn các phản ứng:
2H2 + O2 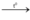 2H2O (pứ hóa hợp + oxi hóa khử)
2H2O (pứ hóa hợp + oxi hóa khử)
4H2 + Fe3O4 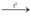 4H2O + 3Fe (pứ thế + oxi hóa khử)
4H2O + 3Fe (pứ thế + oxi hóa khử)
3H2 + Fe2O3 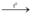 3H2O + 3Fe (pứ thế + oxi hóa khử)
3H2O + 3Fe (pứ thế + oxi hóa khử)
H2 + PbO 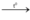 H2O + Pb (pứ thế + oxi hóa khử)
H2O + Pb (pứ thế + oxi hóa khử)
Các phản ứng trên đều là phản ứng oxi – hóa khử vì đều có đồng thời sự khử và sự oxi hóa

\(2H_2+O_2\xrightarrow[]{t^o}2H_2O\\ Fe_2O_3+3H_2\xrightarrow[]{t^o}2Fe+3H_2O\\ Fe_3O_4+4H_2\xrightarrow[]{t^o}3Fe+4H_2O\\ PbO+H_2\xrightarrow[]{t^o}Pb+H_2O\)

2H2 + O2 -to-> H2O (1)
Fe2O3 + H2 -.to-> 2Fe + 3CO2 (2)
Fe3O4 + 4H2-to-> 3Fe +4H2O (3)
PbO + H2 -to-> Pb + H2O (4)
Các phản ứng trên đều là phản ứng oxi hóa khử
Trong đó, H2 là chất khử vì là chất chiếm oxi của chất khác và O2, Fe3O4, Fe2O3, PbO đều là chất oxi hóa vì là chất nhường oxi cho H2 (phản ứng (1) còn được gọi là phản ứng hóa hợp)

2.
\(\left(1\right)2KClO_3\underrightarrow{t^0}2KCl+3O_2\left(phản.ứng.phân,huỷ\right)\\ \left(2\right)2Al+3H_2SO_4\xrightarrow[]{}Al_2\left(SO_4\right)_3+3H_2\left(phản.ứng.thế\right)\\ \left(3\right)Zn+H_2SO_4\xrightarrow[]{}ZnSO_4+H_2\left(phản.ứng.thế\right)\\ \)
(1) Điều chế O2 trong phòng thí nghiệm.
(2), (3) Điều chế H2 trong phòng thí nghiệm.
3.
\(a.\\ n_K=\dfrac{7,8}{39}=0,2\left(mol\right)\\ PTHH:K+H_2O\xrightarrow[]{}KOH+H_2\\ \Rightarrow n_K=n_{H_2}=n_{KOH}=0,2mol\\ V_{H_2}=0,2.22,4=4,48\left(l\right)\\ b.\\ m_{KOH}=0,2.56=11,2\left(g\right)\)
Khi nhúng quì tím vào dung dịch, dung dịch làm quì tím chuyển thành màu xanh.

Câu 1:
a. Phản ứng trao đổi:
2H2(g) + O2(g) → 2H2O(g)
b. Phản ứng oxi-hoá khử:
3Fe2O3(s) + H2(g) → 2Fe3O4(s) + H2O(g)
c. Phản ứng thế:
2K(s) + 2H2O(l) → 2KOH(aq) + H2(g)
d. Không có phản ứng nào xảy ra với H2O và P2O2
Câu 2:
a. Phản ứng trao đổi:
H2(g) + O2(g) → H2O(l)
b. Phản ứng oxi-hoá khử:
PbO(s) + H2(g) → Pb(s) + H2O(l)
c. Phản ứng thế:
2Na(s) + 2H2O(l) → 2NaOH(aq) + H2(g)
d. Phản ứng trao đổi:
K2O(s) + H2O(l) → 2KOH(aq)
c1
\(a,2H_2+O_2\xrightarrow[]{t^0}2H_2O\\ b,3H_2+Fe_2O_3\xrightarrow[]{t^0}2Fe+3H_2O\\ c,2K+2H_2O\xrightarrow[]{}2KOH+H_2\\ d,3H_2O+P_2O_5\xrightarrow[]{}2H_3PO_4\)
b và c là pư thế
vì phản ứng hóa học giữa đơn chất và hợp chất, trong đó nguyên tử của đơn chất thay thế nguyên tử của một nguyên tố khác trong hợp chất.

\(H_2+\dfrac{1}{2}O_2\xrightarrow[]{t^o}H_2O\)
\(H_2O+SO_3\rightarrow H_2SO_4\)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\uparrow\)
\(H_2+CuO\xrightarrow[]{t^o}Cu+H_2O\)
\(Cu+\dfrac{1}{2}O_2\xrightarrow[]{t^o}CuO\)

1) S+ O2 -t--> SO2(phản ứng hoa hợp)
2) 4P+5O2--t--> 2P2O5 (phản ứng hóa hợp )
3) 3Fe+ 2O2 --t--> Fe3O4 (phản ứng hóa hợp )
4) CH4 + 2O2 --> CO2+2H2O ( phản ứng xãy ra sự Oxi hóa)
5 ) 2KMnO4 --t--> K2MnO4 + MnO2+O2 (phản ứng phân hủy)
6) 2H2 + O2 ----> 2H2O(phản ứng hóa hợp )
7) CuO+H2 --t---> Cu +H2O(Phản ứng oxi hóa -khử)
8) Zn + 2HCl ----> ZnCl2 + H2(phản ứng thế)
(1) S + O2 --->(to) SO2 : pứ hóa hợp
(2) 4P + 5O2 --->(to) 2P2O5 : pứ hóa hợp
(3) 3Fe + 2O2 --->(to) Fe3O4 : pứ hóa hợp
(4) CH4 + 2O2 --->(to) CO2 + 2H2O : pứ oxi hóa
(5) 2 KMnO4 --->(to) K2MnO4 + MnO2 + O2 : pứ phân hủy
(6) 2H2 + O2 --->(to) 2H2O : pứ hóa hợp
(7) CuO + H2 --->(to) Cu + H2O : pứ oxi hóa-khử
(8) Zn + 2HCl ---> ZnCl2 + H2 : pứ thế

\(a,S+O_2\underrightarrow{t^o}SO_2\) ( hóa hợp )
\(b,2Al+3O_2\underrightarrow{t^o}2Al_2O_3\) ( hóa hợp )
\(c,2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\uparrow\) ( phân hủy )
\(d,2KClO_3\underrightarrow{t^o}2KCl+3O_2\uparrow\) ( phân hủy )
a) \(S+O_2\xrightarrow[]{t^0}SO_2\left(phản.ứng.hoá.hợp\right)\)
b)\(4Al+3O_2\xrightarrow[t^0]{}2Al_2O_3\left(phản.ứng.hoá.hợp\right)\)
c) \(2KMnO_4\xrightarrow[t^0]{}K_2MnO_4+MnO_2+O_2\left(phản.ứng.phân.huỷ\right)\)
d)\(2KClO_3\xrightarrow[t^0]{}2KCl+3O_2\left(phản.ứng.phân.huỷ\right)\)
Câu 7
\(a.Na+H_2O\xrightarrow[]{}NaOH+H_2\\ K_2O+H_2O\xrightarrow[]{}2KOH\\ SO_2+H_2O\xrightarrow[]{}H_2SO_3\\ P_2O_5+3H_2O\xrightarrow[]{}2H_3PO_4\)
\(b.Fe_2O_3+3H_2\xrightarrow[t^0]{}2Fe+3H_2O\\ HgO+H_2\xrightarrow[]{t^0}Hg+H_2O\\ CuO+H_2\xrightarrow[]{t^0}Cu+H_2O\\ PbO+H_2\xrightarrow[]{t^0}Pb+H_2O\)
Câu 8
\(\left(1\right)2KClO_3\xrightarrow[]{t^0}2KCl+3O_2\)(tác dụng nhiệt, xúc tác)
\(\left(2\right)Al+H_2SO_4\xrightarrow[]{}Al_2\left(SO_4\right)_3+H_2\)(nhiệt độ phòng)
-(1)Phản ứng phân huỷ.
-(2)Phản ứng thế.
-(1)Điều chế khí \(O_2\) trong phòng thí nghiệm.
-(2)Điều chế \(H_2\) trong phòng thí nghiệm
Câu 8 PTHH 2 đã Cân bằng hoá học chưa, Câu 7a PTHH 1 cũng rứa