
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

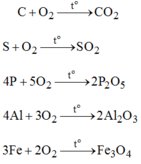

\(a,PTHH:3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
(mol) 3 2 1
(mol) 0,03 0,02 0,01
- Số mol \(Fe_3O_4:n_{Fe_3O_4}=\dfrac{m}{M}=\dfrac{2,32}{232}=0,01\left(mol\right)\)
b. Thể tích khí Oxi cần dùng là:
\(V_{O_2}=n.22,4=0,02.22,4=0,0448\left(l\right)\)
c.
\(PTHH:2KMnO_4\underrightarrow{t^o}K_2MnO_2+MnO_2+O_2\uparrow\)
(mol) 2 1
(mol) 0,04 0,02
Số gam kalipenmaganat cần dùng là:
\(m_{KMnO_4}=n.M=0,04.158=6,32\left(g\right)\)

a/ Lập phương trình hóa học của các phản ứng sau (ghi rõ điều kiện nếu có) và cho biết chúng thuộc loại phản ứng nào?
1/ Sắt từ oxit + hiđro → Sắt + Nước
=> Fe3O4+4H2-to>3Fe+4H2O (oxi hóa khử)
2/ HCl + Nhôm → AlCl3 + Hiđro
2Al+6HCl->2AlCl3+3H2 ( pứ trao đổi
=>pứ điều chế khí hidro
3/ 2 Al + 3 CuCl2 → 2AlCl3 + 3Cu (pứ trao đổi )
4/ N2O5 + 3H2O → 2HNO3 (pứ hóa hợp)
6/ Mg(OH)2 -to→ MgO + H2O (pứ phân hủy )
5/ 2K + 2H2O → 2KOH + H2 (pứ trao đổi )
b/ Trong các phản ứng trên, phản ứng nào được dùng để điều chế khí hiđro trong phòng thí nghiệm ?
Câu a) 1/ Sắt từ oxit + hiđro → Sắt + Nước
=> Fe3O4+4H2-to>3Fe+4H2O (oxi hóa khử)
2/ HCl + Nhôm → AlCl3 + Hiđro
2Al+6HCl->2AlCl3+3H2 ( pứ trao đổi
=>pứ điều chế khí hidro
3/ 2 Al + 3 CuCl2 → 2AlCl3 + 3Cu (pứ trao đổi )
4/ N2O5 + 3H2O → 2HNO3 (pứ hóa hợp)
6/ Mg(OH)2 -to→ MgO + H2O (pứ phân hủy )
5/ 2K + 2H2O → 2KOH + H2 (pứ trao đổi )


1/ a/ Fe2O3 + 3H2 => (to) 2Fe + 3H2O
ZnO + H2 => (to) Zn + H2O
HgO + H2 => (to) Hg + H2O
MgO + H2 => (to) Mg + H2O
b/ H2 + 1/2 O2 => (to) H2O
2KClO3 => (to) 2KCl + 3O2
Mg + 2HCl => MgCl2 + H2
2/ 4H2 + Fe3O4 => (to) 3Fe + 4H2O
nFe3O4 = m/M = 46.4/232 = 0.2 (mol)
Suy ra: nH2 = 0.8 (mol) ==> VH2 = 22.4 x 0.8 = 17.92 (l)
Ta có: nFe = 0.6 (mol)
===> mFe = n.M = 0.6 x 56 = 33.6 (g)

a) PTHH: 4Al + 3O2 =(nhiệt)=> 2Al2O3
nAl = \(\frac{5,4}{27}=0,2\left(mol\right)\)
b) nO2 = \(\frac{0,2\times3}{4}=0,15\left(mol\right)\)
=> VO2(đktc) = 0,15 x 22,4 = 3,36 lít
c) nAl2O3 = \(\frac{0,2\times2}{4}=0,1\left(mol\right)\)
=> mAl2O3 = 0,1 x 102 = 10,2 gam

a) 4Na + O2 -> 2Na2O ( 1 )
b) chất phản ứng : Na tác dụng với O2
Sản phẩm : Na2O
Điều kiện : nhiệt độ
c) Số nguyên tử Na : Số phân tử O2 : Số phân tử Na2O = 4 : 1 : 2
d) ....
e) nNa = 46 : 23 = 2 mol
Từ pt(1) => nO2 = \(\frac{1}{4}nNa=\frac{1}{4}2=\frac{1}{2}\)=0,5mol
=> mO2 = 0,5 . 32 = 16g

Câu 13: (2 điểm) Viết phương trình hóa học của các phản ứng sau, ghi rõ điều kiện phản ứng (nếu có).
a. Đốt sắt thu được sắt từ oxit (Fe;O4).
3Fe + 2O2 -t--> Fe3O4
b. Đốt than (C) thu được cacbonđioxit
C + O2 -t--> CO2.
c. Đốt C4H10 thu được CO2 và H2O.
2C4H10 + 9O2 -t--> 4CO2 + 10H2O
d. Đốt Hiđro thu được nước.
2H2 + O2 -t--> 2H2O

1 ) Fe3O4 + 2H2-t--> 3Fe + 2H2O (phản ứng thế )
2 ) 2Al + 6HCl ----> 2AlCl3 + 3H2 (phản ứng thế )
3 ) 2Al + 3CuCl2 ---> 2AlCl3 + 3Cu (phản ứng thế )
4) N2O5 + H2O --> 2HNO3 (hóa hợp )
5)2K + 2H2O --> 2KOH + H2 ( phản ứng trao đổi )
6)Mg(OH) 2 --> MgO + H2O ( phản ứng phân hủy)
phản ứng để điều chế H2 : 2 , 5