điện phân 500ml dung dịch KOH 1M (d=1,2g/ml) tới khi ở anốt thu được 67,2 lít khí thì ngừng điện phân, thu được dung dịch B.
Tính C% của dung dịch trước điện phân và dung dịch của B
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án B
Ta có:
![]()
![]()
BTNT.Clo → Khí thoát ra ở cực dương phải là Cl2 và O2 .
Ta có
![]()
![]()
Và
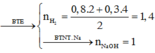
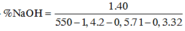
=7,96%

Đáp án : C
Vì ngâm lá sắt vào dung dịch sau điện phân thấy khối lượng tăng => chứng tỏ Cu2+ còn dư
Catot : Cu2+ + 2e -> Cu
Anot : 2H2O -> 4H+ + O2 + 4e
,nO2 = 0,05 mol
=> 4nO2 = 2nCu2+ đp => nCu2+ đp = 0,1 mol
Fe + 2H+ -> Fe2+ + H2
0,1 <- 0,2 mol
Fe + Cu2+ -> Fe2+ + Cu
,x -> x -> x
=> mtăng = 64x – 56(x + 0,1) = 0,8g
=> x = 0,8 mol
=> nCuSO4 bđ = 0,1 + 0,8 = 0,9 mol
=> CM(CuSO4) = 1,8M
Đổi 500ml = 0,5 lít
Ta có: \(n_{KOH}=1.0,5=0,5\left(mol\right)\)
=> \(m_{KOH}=0,5.56=28\left(g\right)\)
Theo đề: \(D=\dfrac{m_{dd_{KOH}}}{500}=1,2\)(g/ml)
=> \(m_{dd_{KOH}}=600\left(g\right)\)
=> \(C_{\%_{KOH}}=\dfrac{28}{600}.100\%=4,7\%\)
Ta có: \(n_{H_2}=\dfrac{67,2}{22,4}=3\left(mol\right)\)
- Ở catot: 2H2O + 2e ---> 2OH- + H2 (1)
Theo PT(1): \(n_{OH}=n_e=n_{H_2O}=2.n_{H_2}=2.3=6\left(mol\right)\)
- Ở anot: 4OH- ---> O2 + 4e + 2H2O (2)
Theo PT(2): \(n_{O_2}=\dfrac{1}{4}.n_e=\dfrac{1}{4}.6=1,5\left(mol\right)\)
Theo PT(2): \(n_{OH}=n_e=6\left(mol\right)\)
Ta thấy lượng OH- không đổi.
=> \(m_{dd_{ban.đầu}}=m_{dd_{KOH}}=600\left(g\right)\)
Ta có: \(m_{dd_{sau}}=m_{dd_{ban.đầu}}-m_{H_2}-m_{O_2}=600-\left(3.2\right)-\left(1,5.32\right)=546\left(g\right)\)
=> \(C_{\%_{dd_{sau.phản.ứng}}}=\dfrac{28}{546}.100\%=5,13\%\)