đốt cháy hoàn toàn 10cm3 một hidrocacbon X bởi 70cm3 oxi lấy dư. Sản phẩm thu dc sau khi cho hơi nước ngưng tụ thì còn 50cm3, tiếp tục dẫn qua dd kiềm dư còn 20cm3 một khí duy nhất thoát ra bị hấp thu hoàn toàn bởi Photpho. Công thức phân tử của X là?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


V nước = = 1250 - 550 = 700(ml)
V nio = 100(ml)
=> V CO2 = 550 - 250 = 300(ml)
Bảo toàn nguyên tố với N :
=> V NH3 = 2 V N2 = 200(ml)
=> V hidrocacbon = 300 -200 = 100(ml)
Ta có :
Số nguyên tử C = V CO2 / V hidrocacbon = 300/100 = 3
Khi đốt NH3, V H2O sinh ra = 3/2 V NH3 = 300(ml)
=> V H2O khi đốt hidrocacbon sinh ra = 700 -300 = 400(ml)
Số nguyên tử H = 2V H2O / V hidrocacbon = 400.2/100 = 8
Vậy CTPT của hidrocacbon là C3H8

Đáp án : C
Vì phản ứng cháy không cho biết có hoàn toàn hay không :
(*) TH1 : Lượng khí thoát ra chính là O2 dư => nO2 pứ = 0,05 mol
, nCaCO3 = 0,03 mol ; nCa(OH)2 = 0,035 mol
+) Nếu OH dư => nCO2 = nCaCO3 = 0,03 mol
Bảo toàn O : 2nO2 = 2nCO2 + nH2O => nH2O = 0,04 mol
=> nC : nH = 0,03 : 0,08 = 3 : 8 => C3H8
+) Nếu có HCO3- => nCaCO3 = nCO3 = nOH – nCO2 => nCO2 = 0,04 mol
Bảo toàn O => nH2O = 0,02
=> nC: nH = 0,04 : 0,04 = 1 : 1 => C2H2 hoặc C4H4
(*) TH2 : Hydrocacbon chưa cháy hết và 2,24 lit khí thoát ra chính là A
+) Nếu OH dư => nCO2 = nCaCO3 = 0,03 mol
Bảo toàn O : 2nO2 = 2nCO2 + nH2O => nH2O = 0,06 mol
=> nC : nH = 0,03 : 0,12 = 1 : 4 => CH4
+) Nếu có HCO3- => nCaCO3 = nCO3 = nOH – nCO2 => nCO2 = 0,04 mol
Bảo toàn O => nH2O = 0,04
=> nC: nH = 0,04 : 0,084 = 1 : 2 => C2H4 ; C3H6 hoặc C4H8
Tổng cộng có 7 chất thỏa mãn

Đáp án B
Vì A là chất khí nên số C < 5
,nCaCO3 = 0,03 mol < nCa(OH)2 = 0,035 mol
+) Nếu OH dư => nCO2 = 0,035 mol
Khí thoát ra khỏi bình có thể có 2 trường hợp :
+) TH1 : là O2 dư => nO2 dư = 0,01 => nO2 pứ = 0,05
Bảo toàn O : nH2O = 2nO2 – 2nCO2 = 0,03 mol
=> nC: nH = 0,035 : 0,06 = 7 : 12 (loại)
+) TH2 : là khí A dư => nH2O = 0,05 mol
=> nC: nH = 0,035 : 0,1 = 7 : 20 (loại)
+)Nếu có hòa tan kết tủa => nCO2 = nOH – nCaCO3 = 0,04 mol
Khí thoát ra khỏi bình có thể có 2 trường hợp :
+) TH1 : là O2 dư => nO2 dư = 0,01 => nO2 pứ = 0,05
Bảo toàn O : nH2O = 2nO2 – 2nCO2 = 0,02 mol
=> nC: nH = 0,04 : 0,04 = 1 : 1 => A là : C2H2 ; C4H4
+) TH2 : là khí A dư => nH2O = 0,04 mol
=> nC: nH = 0,04 : 0,08 = 1 : 2 => A là C2H4 ; C3H6 ; C4H8(3 CTCT)
=> Tổng có 7 CTCT thỏa mãn

\(n_{N_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
\(n_{H_2O}=\dfrac{4,5}{18}=0,25\left(mol\right)\)
\(n_{CaCO_3}=\dfrac{20}{100}=0,2\left(mol\right)\)
PTHH: Ca(OH)2 + CO2 --> CaCO3 + H2O
_______________0,2<------0,2________________(mol)
=> nCO2 = 0,2 (mol)
Bảo toàn C: nC(X) = 0,2 (mol)
Bảo toàn H: nH(X) = 2.0,25 = 0,5 (mol)
Bảo toàn N: nN(X) = 2.0,05 = 0,1 (mol)
=> \(n_O=\dfrac{7,5-0,2.12-0,5.1-0,1.14}{16}=0,2\left(mol\right)\)
=> nC : nH : nO : nN = 0,2 : 0,5 : 0,2 : 0,1 = 2:5:2:1
=> CTPT: (C2H5O2N)n




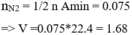
Đổi 10 cm3=10 ml,50cm3=50ml,70cm3=70ml,20cm3=20ml.Sản phẩm sau khi đốt cháy và ngưng tụ hơi nước có thể tích =50ml bao gồm:CO2,O2 dư,sau khi dẫn sản phẩm qua dung dịch kiềm dư thì CO2 được hấp thu vào trong dung dịch kiềm còn 20ml khí thoát ra là thể tích O2 dư=>VCO2 thu được sau khi đốt cháy=50-20=30(ml) và thể tích oxi phản ứng=70-20=50 ml.ta có pt: CxHy +(x+y/4)--->xCO2+y/2 H2O (1)
10ml--------------->x.10ml---->y/2.10ml
lại có VCO2=30=10.x=>x=3,bảo toàn nguyên tố Oxi ta có VO pu=VO(CO2)+VO(H2O)=2.VCO2+VH2O=>VH2O=50.2-30.2=40ml,lại có VH2O=y/2.10=40=>y=8
=> CTPT của X là C3H8.