Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Số mol H2 thu được là: n H 2 = 0 , 3 mol
Đặt số mol các chất trong X là Zn: a mol ; Fe: b mol.
m Zn + m Fe = m X ⇒ 65 a + 56 b = 18 , 6 ( I )
Sơ đồ phản ứng:
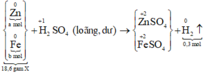
Các quá trình nhường, nhận electron:
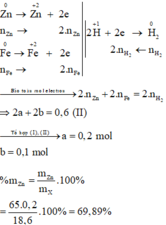

a) rZn = 1,35. 10-1 nm = 0,135.10-7 cm (1nm = 10-9m)
1u = 1,6600.10-24 g.
mZn = 65.1,6600.10-24 g = 107,9.10-24g.
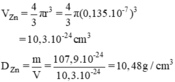
b) mhạt nhân Zn = 65u ⇒ 107,9.10-24 gam.
rhạt nhân Zn = 2.10-6nm = (2.10-6.10-7)cm = 2.10-13 cm.
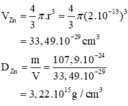

r = 1,38\(A^0\)= 1,38 . \(10^{-8}\)cm
a) Khối lượng riêng của kẽm :
\(r=\sqrt[3]{\dfrac{3Ma}{4\pi DN}}\)
⇔ 1,38 . \(10^{-8}\)= \(\sqrt[3]{\dfrac{3.65.100\%}{4.\pi.D.6,023.10^{23}}}\)
⇔ \(\left(1,38.10^{-8}\right)^3\) = \(\dfrac{3.65.100\%}{4.\pi.D.6,023.10^{23}}\)
⇔ D ≃ 9,803 (g/\(cm^3\))
Vậy khối lượng riêng của kẽm là 9,803g/\(cm^3\)
b) Khối lượng riêng đúng của kẽm :
\(D_{thực}=D.\dfrac{72,5}{100}\)= 9,803 . \(\dfrac{72,5}{100}\)≃ 7,107 (g/\(cm^3\))

a)
Zn + 2HCl → ZnCl2 + H2
Fe + 2HCl → FeCl2 + H2
b) Gọi số mol Zn và Fe có trong 17,7 gam hỗn hợp là x và y mol. nH2 = \(\dfrac{6,72}{22,4}\)=0,3 mol
Theo tỉ lệ phản ứng ta có \(\left\{{}\begin{matrix}x+y=0,3\\65x+56y=17,7\end{matrix}\right.\)=> x = 0,1 và y = 0,2
=> mZn = 0,1.65 = 6,5 gam và mFe= 0,2.56 = 11,2 gam
c) nHCl = 2nH2 = 0,3.2 = 0,6 mol
Áp dụng ĐLBT khối lượng => m muối clorua = mKl + mHCl - mH2
<=> m muối = 17,7 + 0,6.36,5 - 0,3.2 = 28,05 gam

n AgNO 3 = 0,1 x 0,1 = 0,01 mol
Zn + 2 AgNO 3 → Zn NO 3 2 + 2Ag
m Ag = 0,01 x 108 = 1,08g
m Zn = 65 x 0,005 = 0,325g
