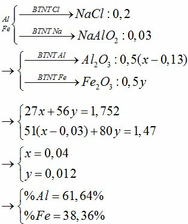Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Đặt nK = a và nAl = b ta có:
39a + 27b = 10,5 (1)
\(K+H_2O\rightarrow KOH+\dfrac{1}{2}H_2\)
a............................a
\(Al+KOH+H_2O\rightarrow KAlO_2+\dfrac{3}{2}H_2\)
b...........b...............................b
Thêm từ từ HCl vào dd A lúc đầu không có kết tủa do HCl trung hòa KOH dư:
\(HCl+KOH\rightarrow KCl+H_2O\)
(a-b)<-----(a-b)
Khi HCl trung hòa hết KOH dư thì xuất hiện kết tủa:
KAlO2 + HCl + H2O → Al(OH)3 + KCl
Để trung hòa hết KOH cần: 0,1. 1 = 0,1 mol HCl
a – b = nHCl = 0,1 (2)
Giải hệ (1) và (2) ta có: a = 0,2 và b = 0,1
=> \(\%m_K=\dfrac{0,2.39}{10,5}=74,29\%\); \(\%m_{Al}=25,71\%\)


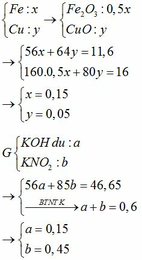
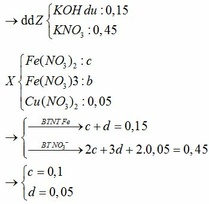

BTKL
mX + mdd HNO3 = mdd X + mH2O + m↑
=> mdd X = 11,6 + 87,5 – 30 . 0,1 – 46 . 0,15 = 89,2g
=> C%Fe(NO3)3 = 13,565%

Em tham khảo nhé !
Đặt nAl = a và nFe = b
—> 27a + 56b = 3,28 (1)
nHCl = 0,5 và nNaOH = 0,65
—> nNaCl = 0,5
TH1: Nếu kết tủa vẫn còn Al(OH)3 —> nNaAlO2 = 0,65 – 0,5 = 0,15
Kết tủa gồm Fe(OH)2 (b) và Al(OH)3 (a – 0,15)
Nung ngoài không khí —> Al2O3 (a – 0,15)/2 và Fe2O3 (b/2)
m rắn = 102(a – 0,15)/2 + 160b/2 = 1,6 (2)
(1)(2) —> Vô nghiệm, loại
TH2: Kết tủa chỉ có Fe(OH)2 (b mol)
—> m rắn = 160b/2 = 1,6 (3)
(1)(3) —> a = 0,08 và b = 0,02
—> %Al = 65,85% và %Fe = 34,15%

Ta có nH2 = 3,36/22,4 = 0,15 mol
Fe +2 HCl -> FeCl2 + H2
0,15. 0,3 <-. 0,15. ( Mol)
=> mFe = 0,15 × 56 = 8,4g
=> %Fe = 8,4/15×100% = 56%
=> %Cu = 100% - 56% = 44%
=>VHCl =1\0,3=10\3 l

\(n_{HCl}=2.0,4=0,8(mol)\\ n_{Fe}=x(mol);n_{Al}=y(mol)\\ \Rightarrow 56x+27y=11(1)\\ Fe+2HCl\to FeCl_2+H_2\\ 2Al+6HCl\to 2AlCl_3+3H_2\\ \Rightarrow 2x+3y=0,8(2)\\ (1)(2)\Rightarrow x=0,1(mol);y=0,2(mol)\)
\(a,\Sigma n_{H_2}=x+1,5y=0,4(mol)\\ \Rightarrow V_{H_2}=0,4.22,4=8,96(l)\\ b,m_{Fe}=0,1.56=5,6(g);m_{Al}=0,2.27=5,4(g)\\ c,m_{dd_{HCl}}=400.1,12=448(g)\\ n_{FeCl_2}=0,1(mol);n_{AlCl_3}=0,2(mol)\\ \Rightarrow C\%_{FeCl_2}=\dfrac{0,1.127}{5,6+448-0,1.2}.100\%=2,8\%\\ C\%_{AlCl_3}=\dfrac{0,2.133,5}{5,4+448-0,3.2}.100\%=5,9\%\)