Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Pt : Fe + 2HCl → FeCl2 + H2\(|\)
1 2 1 1
0,045 0,09 0,045
Số mol của khí hidro ở dktc
nH2 = \(\dfrac{V_{H2}}{22,4}=\dfrac{1,008}{22,4}=0,045\left(mol\right)\)
a) Số mol của sắt
nFe = \(\dfrac{0,045.1}{1}=0,045\left(mol\right)\)
Khối lượng của sắt
mFe = nFe . MFe
= 0,045 . 56
= 2,52 (g)
Khối lượng của bạc
mAg = 4,68 - 2,52
= 2,16 (g)
b) 0/0Fe = \(\dfrac{m_{Fe}.100}{m_{hh}}=\dfrac{2,52.100}{4,68}=\) 53,850/0
0/0Ag = \(\dfrac{m_{Ag}.100}{m_{hh}}=\dfrac{2,16.100}{4,68}=\) 46,150/0
c) Số mol của dung dịch axit clohidric
nHCl = \(\dfrac{0,045.2}{1}=0,09\left(mol\right)\)
Thể tích của dung dịch axit clohidric đã dùng
CM = \(\dfrac{n}{V}\Rightarrow V=\dfrac{n}{C_M}\) = \(\dfrac{0,09}{2}=0,045\left(M\right)\)
Chúc bạn học tốt
Mình xin lỗi bạn nhé , bạn sửa đơn vị của thể tích thành ' lít' giúp mình nhé , tại mình bấm lộn

a. PTHH:
Fe + 2HCl ---> FeCl2 + H2 (1)
Mg + 2HCl ---> MgCl2 + H2 (2)
b. Gọi x, y lần lượt là số mol của Fe và Mg
Ta có: \(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
Theo PT(1): \(n_{H_2}=n_{Fe}=x\left(mol\right)\)
Theo PT(2): \(n_{H_2}=n_{Mg}=y\left(mol\right)\)
\(\Rightarrow x+y=0,25\) (*)
Theo đề, ta lại có: 56x + 24y = 8,25 (**)
Từ (*) và (**), ta có HPT:
\(\left\{{}\begin{matrix}x+y=0,25\\56x+24y=8,25\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x\approx0,07\\y\approx0,18\end{matrix}\right.\)
=> \(m_{Fe}=0,07.56=3,92\left(g\right)\)
=> \(\%_{m_{Fe}}=\dfrac{3,92}{8,25}.100\%=47,52\%\)
\(\%_{m_{Mg}}=100\%-47,52\%=52,48\%\)

1.
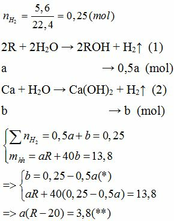
Vì b > 0, từ (*) => a < 0,25/0,5 = 0,5 thế vào (**)
=> R – 20 > 7,6
=> R > 27,6 (***)
Khi cho 8,58 gam R tác dụng với lượng dư HCl thì lượng H2 thoát ra lớn hơn 2,24 (lít)
2R + 2HCl → 2RCl + H2↑ (3)
Theo PTHH (3):
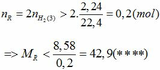
Từ (***) và (****) => 27, 6 < MR < 42,9
Vậy MR = 39 (K) thỏa mãn
2.
Ta có:
=> nKOH = nK = 0,2 (mol)
nCa(OH)2 = nCa = 0,15 (mol)
∑ nOH- = nKOH + 2nCa(OH)2 = 0,2 + 2.0,15 = 0,5 (mol)
Khi cho hỗn hợp Z ( N2, CO2) vào hỗn hợp Y chỉ có CO2 phản ứng
CO2 + OH- → HCO3- (3)
CO2 + 2OH- → CO32- + H2O (4)
CO32- + Ca2+ → CaCO3↓ (5)
nCaCO3 = 8,5/100 = 0,085 (mol) => nCO32-(5) = nCaCO3 = 0,085 (mol)
Ta thấy nCaCO3 < nCa2+ => phương trình (5) Ca2+ dư, CO32- phản ứng hết
TH1: CO2 tác dụng với OH- chỉ xảy ra phản ứng (4)
Theo (4) => nCO2 = nCO32-(4) = nCaCO3 = 0,085 (mol)
=> VCO2(đktc) = 0,085.22,4 = 1,904 (lít)
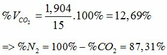
TH2: CO2 tác dụng với OH- xảy ra cả phương trình (3) và (4)
Theo (4): nCO2 = nCO32- = 0,085 (mol)
nOH- (4) = 2nCO32- = 2. 0,085 = 0,17 (mol)
=> nOH- (3)= ∑ nOH- - nOH-(4) = 0,5 – 0,17 = 0,33 (mol)
Theo PTHH (3): nCO2(3) = nOH- = 0,33 (mol)
=> ∑ nCO2(3+4) = 0,085 + 0,33 = 0,415 (mol)
=> VCO2 (ĐKTC) = 0,415.22,4 = 9,296 (lít)
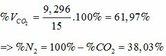

a,\(n_{H_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
PTHH: Zn + 2HCl → ZnCl2 + H2
Mol: x x
PTHH: Fe + 2HCl → FeCl2 + H2
Mol: y y
Ta có: \(\left\{{}\begin{matrix}65x+56y=30,7\\x+y=0,5\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,3\left(mol\right)\\y=0,2\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\%m_{Zn}=\dfrac{0,3.65.100\%}{30,7}=63,52\%;\%m_{Fe}=100\%-63,52\%=36,48\%\)
b,
PTHH: Zn + 2HCl → ZnCl2 + H2
Mol: 0,3 0,6
PTHH: Fe + 2HCl → FeCl2 + H2
Mol: 0,2 0,4
nHCl = 0,6+0,4 = 1 (mol)
\(V_{ddHCl}=\dfrac{1}{2}=0,5\left(l\right)=500\left(ml\right)\)

a/ Fe + 2HCl \(\rightarrow\) FeCl2 + H2
nH2 = \(\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
Theo PTHH: nH2 = nFe = 0,15 (mol) \(\Rightarrow m_{Fe}=0,15.56=8,4\left(g\right)\)
\(\Rightarrow m_{Cu}=11-8,4=2,6\left(g\right)\)
\(\Rightarrow\%m_{Fe}=\dfrac{8,4}{11}.100\%\approx76,4\%\)
\(\Rightarrow\%m_{Cu}=100-76,4\approx23,6\%\)
b/ Theo PTHH ta có: nHCl = 2nFe = 2.0,15 = 0,3 (mol)
\(\Rightarrow V_{ddHCl}=\dfrac{0,3}{2}=0,15\left(M\right)\)
c/ mHCl = 36,5 . 0,3 = 10,95(g)
\(\Rightarrow C\%_{HCl}=\dfrac{m_{HCl}}{m_{ddHCl}}.100\%=\dfrac{10,95}{200}.100\%=5,475\%\)

a, PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
Ta có: \(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
Theo PT: \(n_{Fe}=n_{H_2}=0,15\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{0,15.56}{11}.100\%\approx76,36\%\\\%m_{Cu}\approx23,64\%\end{matrix}\right.\)
b, Theo PT: \(n_{HCl}=2n_{H_2}=0,3\left(mol\right)\)
\(\Rightarrow V_{ddHCl}=\dfrac{0,3}{2}=0,15\left(l\right)\)
c, \(C\%_{HCl}=\dfrac{0,3.36,5}{200}.100\%=5,475\%\)
Ta có nH2 = 3,36/22,4 = 0,15 mol
Fe +2 HCl -> FeCl2 + H2
0,15. 0,3 <-. 0,15. ( Mol)
=> mFe = 0,15 × 56 = 8,4g
=> %Fe = 8,4/15×100% = 56%
=> %Cu = 100% - 56% = 44%
=>VHCl =1\0,3=10\3 l
PTHH : 2Fe + 6HCl --> 2FeCl3 + 3H2 (1)
nH2 = \(\dfrac{3.36}{22.4}=0.15\left(mol\right)\)
Từ (1) -> nFe = \(\dfrac{2}{3}n_{H_2}=0.1\left(mol\right)\)
-> mFe = n.M = 0,1 . 56 = 5.6 (g) => %mFe = \(\dfrac{5.6}{15}x100\%\approx37.3\%\)
-> %mCu = 100% - 37.3% = 62.7 %