Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


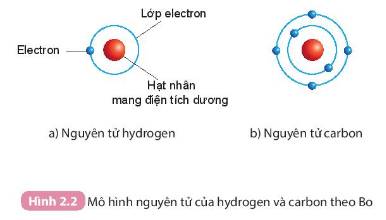
Áp dụng mô hình nguyên tử của Bo
- Nguyên tử hydrogen:
+ Hạt nhân nằm ở tâm, mang điện tích dương
+ Có 1 electron (mang điện tích âm) nằm ở lớp thứ nhất, quay xung quanh hạt nhân
- Nguyên tử carbon:
+ Hạt nhân nằm ở tâm, mang điện tích dương
+ Có 2 lớp electron và 6 electron phân bố ở các lớp: lớp thứ nhất có 2 electron, lớp thứ 2 có 4 electron. Các electron quay xung quanh hạt nhân.

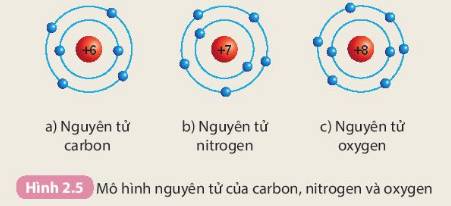
Các số điền hàng carbon lần lượt là: 6 - 6 - 2 - 4
Các số điền hàng oxygen lần lượt là: 8 - 8 - 2 - 6
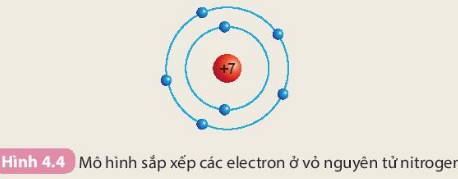
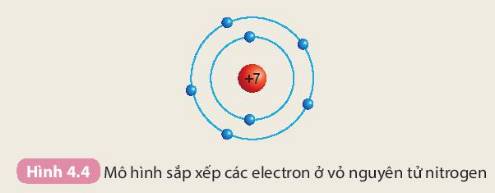
Các số điền hàng nitrogen lần lượt là: 7 - 7 - 2 - 5

1. Nguyên tử nguyên tố H , nguyên tử nguyên tố He có 1 lớp e
Nguyên tử nguyên tố Li, Be, C, N có 2 lớp e.
2. STT chu kì của nguyên tử nguyên tố H, He (1) < STT chu kì của nguyên tử nguyên tố Li, Be, C, N (2)

1:
Nguyên tử Li, Na có cũng số electron ở lớp ngoài cùng
Nguyên tử F, Cl có cũng số electron ở lớp ngoài cùng
2: Số electron lớp ngoài cùng của nguyên tử các nguyên tố chính là số thứ tự nhóm của các nguyên tố

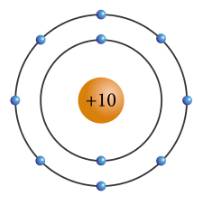
a: X có 10electron và có 2 lớp electron
b: X là neon
c: Oxy, Nitơ,cacbon

`-` Khi hình thành liên kết cộng hóa trị trong phân tử `CO_2`, các nguyên tử đã liên kết với nhau như sau:
Mỗi nguyên tử `C` và `O` lần lượt có `12e` và `16e`. Để hình thành phân tử `CO_2`, nguyên tử `C` đã liên kết với `2` nguyên tử `O` bằng cách nguyên tử `C` góp chung với mỗi nguyên tử `O` là `2e` ở lớp ngoài cùng tạo thành các cặp electron dùng chung.
`NH_3`
Mỗi nguyên tử `N` và `H` lần lượt có `14e` và `1e`. Để hình thành phân tử ammonia, nguyên tử `N` liên kết với nguyên tử `H` bằng cách nguyên tử `N` góp chung với nguyên tử `H` là `1e` ở lớp ngoài cùng tạo thành `3` cặp electron dùng chung.