Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án B
gt ⇒ Z gồm N2O, N2, H2 ⇒ Y không chứa NO3–; khí có PTK lớn nhất trong Z là N2O.
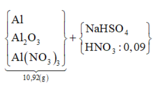
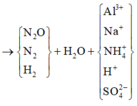
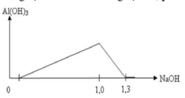
Từ 1 mol NaOH đến 1,3 mol NaOH thì kết tủa từ cực đại đến tan hết do xảy ra phản ứng:
Al(OH)3 + NaOH → NaAlO2 + 2H2O ⇒ nAl3+ = nAl(OH)3 = 1,3 - 1 = 0,3 mol.
Đặt nNaHSO4 = x ⇒ nNa+/Y = nSO42– = x. Khi kết tủa đạt cực đại thì chỉ thu được Na2SO4.
⇒ nNa2SO4 = x ⇒ ∑nNa+ = 2x ⇒ nNa+/Y = 2x - 1 = x ⇒ x = 1.
Đặt nNH4+ = y; nH+ = z. Bảo toàn điện tích: 0,3 × 3 + 1 + y + z = 1 × 2
mmuối = 127,88(g) = 0,3 × 27 + 1 × 23 + 18y + z + 1 × 96
Giải hệ có: y = 0,04 mol; z = 0,06 mol. Bảo toàn khối lượng:
mH2O = 10,92 + 1 × 120 + 0,09 × 63 - 127,88 - 0,08 × 20 = 7,11g ⇒ nH2O = 0,395 mol.
Bảo toàn nguyên tố Hidro: nH2 = (1 + 0,09 - 0,04 × 4 - 0,06 - 0,395 × 2)/2 = 0,04 mol.
Đặt nN2O = a; nN2 = b ⇒ nZ = a + b + 0,04 = 0,08; mZ = 44a + 28b + 0,04 × 2 = 0,08 × 20
Giải hệ có: a = 0,025 mol; b = 0,015 mol ⇒ %mN2O = 0,025 × 44 ÷ 1,6 × 100% = 68,75%.

Đáp án D
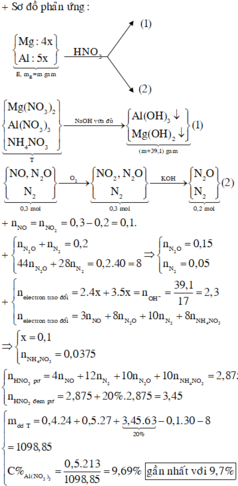
nH2SO4 = 0,565 mol ; nSO2 = 0,015 mol
+) Phần 1 : Mkhí = 32,8g ; nkhí = 0,0625 mol
Hỗn hợp khí không màu có 1 khí hóa nâu là NO và N2O
=> nNO = 0,05 ; nN2O = 0,0125 mol
Muối thu được là muối sunfat => có S trog D
Qui hỗn hợp D về dạng : Al (x mol) ; O (y mol) ; S (z mol)
Giả sử phản ứng D + HNO3 tạo t mol NH4+
Bảo toàn e : 3nAl + 6nS = 2nO + 3nNO + 8nN2O + 8nNH4
=>3x + 6z = 2y + 0,15 + 0,1 + 8t(1)
Muối sunfat thu được có : NH4+ ; Al3+ ; SO42-
Bảo toàn điện tích : nNH4 + 3nAl = 2nSO4
=>t + 3x = 2z(2)
Khi Cho dung dịch muối này phản ứng với NaOH vừa đủ thì :
Al3+ + 4OH- -> AlO2- + 2H2O
NH4+ + OH- -> NH3 + H2O
=> nNaOH = 4x + t = 0,13(3)
+) Phần 2 : (Al ; O ; S) + O2(không khí) -> ( 0,5x mol Al2O3) + SO2 ↑
=> mgiảm = mS – mO thêm
=>1,36 = 32z – 16.(1,5x – y)(4)
Giải hệ (1,2,3,4) => x = y = 0,03 ; z = 0,05 ; t = 0,01 mol
Vậy D có : 0,02 mol Al2O3 ; 0,02 mol Al ; 0,1 mol S
Bảo toàn e : 2nSO2 + 6nS = 3nAl pứ => nAl pứ = 0,21 mol
nH2SO4 = 3nAl2O3 pứ + (1,5nAl + nSO2 + nS)
=> nAl2O3 = 0,045 mol
Vậy hỗn hợp đầu có : 0,065 mol Al2O3 và 0,23 mol Al
=> m = 12,84g

Giải thích:
nH2SO4 = 0,565 mol ; nSO2 = 0,015 mol
+) Phần 1 : Mkhí = 32,8g ; nkhí = 0,0625 mol
Hỗn hợp khí không màu có 1 khí hóa nâu là NO và N2O
=> nNO = 0,05 ; nN2O = 0,0125 mol
Muối thu được là muối sunfat => có S trog D
Qui hỗn hợp D về dạng : Al (x mol) ; O (y mol) ; S (z mol)
Giả sử phản ứng D + HNO3 tạo t mol NH4+
Bảo toàn e : 3nAl + 6nS = 2nO + 3nNO + 8nN2O + 8nNH4
=> 3x + 6z = 2y + 0,15 + 0,1 + 8t (1)
Muối sunfat thu được có : NH4+ ; Al3+ ; SO42-
Bảo toàn điện tích : nNH4 + 3nAl = 2nSO4
=> t + 3x = 2z (2)
Khi Cho dung dịch muối này phản ứng với NaOH vừa đủ thì :
Al3+ + 4OH- -> AlO2- + 2H2O
NH4+ + OH- -> NH3 + H2O
=> nNaOH = 4x + t = 0,13 (3)
+) Phần 2 : (Al ; O ; S) + O2(không khí) -> ( 0,5x mol Al2O3) + SO2 ↑
=> mgiảm = mS – mO thêm
=> 1,36 = 32z – 16.(1,5x – y) (4)
Giải hệ (1,2,3,4) => x = y = 0,03 ; z = 0,05 ; t = 0,01 mol
Vậy D có : 0,02 mol Al2O3 ; 0,02 mol Al ; 0,1 mol S
Bảo toàn e : 2nSO2 + 6nS = 3nAl pứ => nAl pứ = 0,21 mol
nH2SO4 = 3nAl2O3 pứ + (1,5nAl + nSO2 + nS)
=> nAl2O3 = 0,045 mol
Vậy hỗn hợp đầu có : 0,065 mol Al2O3 và 0,23 mol Al
=> m = 12,84g
Đáp án D
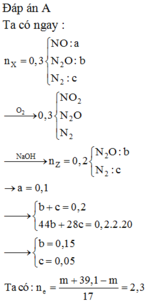


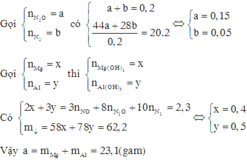
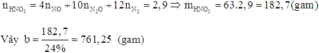
Đáp án A
Xử Lý hỗn hợp khí X: 3 khí đó chỉ có thể là NO, N2 và N2O.
NO + ½O2 → NO2 và bị giữ lại bởi NaOH.
⇒ Hỗn hợp khí Y chứa N2 và N2O với MTrung bình = 36 = MTrung bình cộng của 2 khí.
⇒ nN2 = nN2O || Đặt nNO = a và nN2 = nN2O = b ta có hệ:
a + 2b = 0,04 || 30a + 28b + 44b = 1,32 ||⇒ a = 0,02 và b = 0,01.
⇒ ∑ne cho nhận = 3nNO + 10nN2 + 8nN2O = 0,24 mol.
● Đặt số mol 2 kim loại lần lượt là x và y ta có hệ:
(24+17×2)x + (27+17×3)y = 6,42 || 2x + 3y = 0,24.
⇒ nMg = 0,03 và nAl = 0,06 mol ⇒ mHỗn hợp kim loại = 2,34 gam
+ Bảo toàn nguyên tố Nitơ ⇒ nHNO3 đã pứ = 0,24 + 0,02 + 0,01×2×2 = 0,3 mol.
⇒ ∑nHNO3 ban đầu = 0,3 + 0,3×0,15 = 0,345 mol.
⇒ mDung dịch HNO3 = 0 , 345 × 63 × 100 24 = 90,5625 gam