Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
nH2SO4 = 0,565 mol ; nSO2 = 0,015 mol
+) Phần 1 : Mkhí = 32,8g ; nkhí = 0,0625 mol
Hỗn hợp khí không màu có 1 khí hóa nâu là NO và N2O
=> nNO = 0,05 ; nN2O = 0,0125 mol
Muối thu được là muối sunfat => có S trog D
Qui hỗn hợp D về dạng : Al (x mol) ; O (y mol) ; S (z mol)
Giả sử phản ứng D + HNO3 tạo t mol NH4+
Bảo toàn e : 3nAl + 6nS = 2nO + 3nNO + 8nN2O + 8nNH4
=>3x + 6z = 2y + 0,15 + 0,1 + 8t(1)
Muối sunfat thu được có : NH4+ ; Al3+ ; SO42-
Bảo toàn điện tích : nNH4 + 3nAl = 2nSO4
=>t + 3x = 2z(2)
Khi Cho dung dịch muối này phản ứng với NaOH vừa đủ thì :
Al3+ + 4OH- -> AlO2- + 2H2O
NH4+ + OH- -> NH3 + H2O
=> nNaOH = 4x + t = 0,13(3)
+) Phần 2 : (Al ; O ; S) + O2(không khí) -> ( 0,5x mol Al2O3) + SO2 ↑
=> mgiảm = mS – mO thêm
=>1,36 = 32z – 16.(1,5x – y)(4)
Giải hệ (1,2,3,4) => x = y = 0,03 ; z = 0,05 ; t = 0,01 mol
Vậy D có : 0,02 mol Al2O3 ; 0,02 mol Al ; 0,1 mol S
Bảo toàn e : 2nSO2 + 6nS = 3nAl pứ => nAl pứ = 0,21 mol
nH2SO4 = 3nAl2O3 pứ + (1,5nAl + nSO2 + nS)
=> nAl2O3 = 0,045 mol
Vậy hỗn hợp đầu có : 0,065 mol Al2O3 và 0,23 mol Al
=> m = 12,84g

Đáp án A
· Có n Al ( B ) = 2 3 . n H 2 = 2 3 . 0 , 672 22 , 4 = 0 , 02 mol
· Chất rắn thu được sau khi nung là Al2O3:
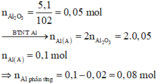
· Quy đổi A tương đương với hỗn hợp gồm 0,1 mol Al, a mol Fe, b mol O
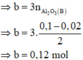
· Phần không tan D gồm Fe và oxit sắt + H2SO4 ® Dung dịch E + 0,12 mol SO2
Dung dịch E chứa một muối sắt duy nhất và không hòa tan được bột Cu
Þ Muối sắt là FeSO4.
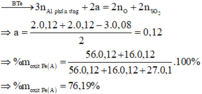

Đáp án A
Ta có khối lượng mỗi phần là 30,66 gam.
Cho phần một tác dụng với NaOH dư thu được 0,09 mol H2 do vậy trong X chứa Al dư.
Vậy trong mỗi phần chứa Fe, Al2O3 và Al dư 0,06 mol.
Cho phần 2 tác dụng với 1,74 mol HNO3 thu được 0,18 mol NO. Cô cạn dung dịch Y thu được các muối, nung rắn tới khối lượng không đổi thu được rắn chứa Al2O3 và Fe2O3 có số mol bằng nhau.
Gọi số mol của Fe, Al2O3 trong mỗi phần lần lượt là a, b
![]()
Và a=2b+0,06
Giải hệ: a=0,3; b=0,12.
Gọi x là số mol NH4NO3 có thể tạo ra.
Bảo toàn N:
n N O 3 - t r o n g m u o i K l = 1 , 74 - 0 , 18 - 2 x = 1 , 56 - 2 x
Bảo toàn e: 1 , 56 - 2 x = 0 , 12 . 6 + 0 , 18 . 3 + 8 x
Vậy NO3– trong muối là 1,5 mol.
Muối trong Y gồm Al(NO3)3 0,3 mol, Fe(NO3)2 0,3 mol và NH4NO3 0,03 mol.
Cho Y tác dụng với Na2CO3 dư thu được kết tủa là Al(OH)3 0,3 mol và FeCO3 0,3 mol.
→ a = 58 , 2 g

Đáp án A
Đặt số mol ![]() lần lượt là x, y , z mol
lần lượt là x, y , z mol
Hỗn hợp khí có 30 > M > 21,6 >2 và có 1 khí hóa nâu => Z gồm
![]()
Khi đó ta có hệ

Vì sinh ra H 2 nên toàn bộ lượng
![]()
chuyển hóa thành NO : 0,07 mol và N H 4 +
Bảo toàn nguyên tố
N![]()
Luôn có:
![]()
=> 1,04 +0,08 = 2.0,03 + 0,07+10x(2z+0,01)+2.4y ⇔ 8y + 20z = 0,68
Trong 20,8 gam chất rắn gồm MgO: x mol và F e 2 O 3 : 0,5.(3y+z)
Ta có hệ:
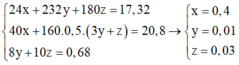
Bảo toàn electron cho toàn bộ quá trình
![]()
![]()
![]()
![]()
=>Kết tủa thu được
![]()
![]()

Đáp án C
Sau phản ứng thu được hỗn hợp kim loại C => Chứng tỏ C chứa Ag, Cu, có thể có Fe dư, Al dư.
Có khối lượng chất rắn thu được ở phần 1 nhiều hơn phần 2 => Chứng tỏ trong dung dịch ngoài Al(NO3)3 còn chứa Fe(NO3)2
=> Al, Cu(NO3)2 và AgNO3 phản ứng hết, Fe có thể còn dư.
Đặt số mol Cu(NO3)2 và AgNO3 lần lượt là a, b.
Đặt số mol Al và Fe phản ứng lần lượt là x, ỵ
Chất rắn thu được ở phần 2 là Fe2O3 => 160.0,5y = 6,2 => y = 0,15
Chất rắn thu được ở phần 1 là Al2O3 và Fe2O3
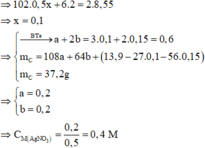

Đáp án B
Z chắc chắn phải chứa CO2. Lại có MZ = 44 = MCO2 ⇒ khí còn lại cũng có M = 44.
⇒ Khí còn lại là N2O || NaOH + Y → ↓ rồi nung ⇒ chỉ có MgO ⇒ nMg2+ = 0,34 mol.
► Ta có sơ đồ sau:

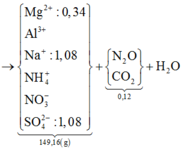
Bảo toàn khối lượng: mH2O = 11,16(g) ⇒ nH2O = 0,62 mol. Bảo toàn nguyên tố Hidro:
⇒ nNH4+ = (1,08 + 0,32 - 0,62 × 2) ÷ 4 = 0,04 mol || Đặt nAl3+ = x; nNO3– = y
⇒ mmuối = 27x + 62y + 137,4 = 149,16(g) || Bảo toàn điện tích: 3x - y = 0,36 mol.
► Giải hệ có: x = 0,16 mol; y = 0,12 mol. Bảo toàn nguyên tố Nitơ: nN2O = 0,08 mol.
⇒ nMgCO3 = nCO2 = 0,04 mol. Bảo toàn nguyên tố Mg: nMg = 0,32 mol.
● ∑nH+ = 10nNH4+ + 10nN2O + 2nO + 2nCO3 ⇒ nO = 0,06 mol
⇒ nAl2O3 = 0,02 mol ||⇒ %mAl2O3 = 0,02 × 102 ÷ 15,84 × 100% = 12,88%

Đáp án A
Trong các sản phẩm khử có H2 nên NO3- hết
Sau khi tác dụng với NaOH thì dung dịch thu được chỉ gồm NaCl là KCl
→ nHCl = nNaCl + nKCl = nNaOH + nKNO3 = 0,9mol
Bảo toàn H có nHCl = 2nH2 + 4nNH4 + 2nH2O
→ nH2O = 0,4 mol
BTKL : mA + mHCl + mKNO3 = mmuối + mH2O + mC
→ mA = 20,6 gam
Đặt a, b,c, d lần lượt là số mol của Mg, MgCO3, Fe, Fe(NO3)2
Có mA = 24a + 84b + 56c + 180d =20,6
nO = 3b+ 6d = 20,6. %O : 16 = 0,48
mmuối = 24(a+b) + 56(c + d ) + 0,07.39 + 0,01.18 + 0,09.35,5 = 45,74
moxit = 40 (a +b ) + 160 (c + d ) . ½ = 17,6
Giải hệ được a =0,26; b = 0,1; c= 0,01; d=0,03
→ %Fe = 2,7 %



Giải thích:
nH2SO4 = 0,565 mol ; nSO2 = 0,015 mol
+) Phần 1 : Mkhí = 32,8g ; nkhí = 0,0625 mol
Hỗn hợp khí không màu có 1 khí hóa nâu là NO và N2O
=> nNO = 0,05 ; nN2O = 0,0125 mol
Muối thu được là muối sunfat => có S trog D
Qui hỗn hợp D về dạng : Al (x mol) ; O (y mol) ; S (z mol)
Giả sử phản ứng D + HNO3 tạo t mol NH4+
Bảo toàn e : 3nAl + 6nS = 2nO + 3nNO + 8nN2O + 8nNH4
=> 3x + 6z = 2y + 0,15 + 0,1 + 8t (1)
Muối sunfat thu được có : NH4+ ; Al3+ ; SO42-
Bảo toàn điện tích : nNH4 + 3nAl = 2nSO4
=> t + 3x = 2z (2)
Khi Cho dung dịch muối này phản ứng với NaOH vừa đủ thì :
Al3+ + 4OH- -> AlO2- + 2H2O
NH4+ + OH- -> NH3 + H2O
=> nNaOH = 4x + t = 0,13 (3)
+) Phần 2 : (Al ; O ; S) + O2(không khí) -> ( 0,5x mol Al2O3) + SO2 ↑
=> mgiảm = mS – mO thêm
=> 1,36 = 32z – 16.(1,5x – y) (4)
Giải hệ (1,2,3,4) => x = y = 0,03 ; z = 0,05 ; t = 0,01 mol
Vậy D có : 0,02 mol Al2O3 ; 0,02 mol Al ; 0,1 mol S
Bảo toàn e : 2nSO2 + 6nS = 3nAl pứ => nAl pứ = 0,21 mol
nH2SO4 = 3nAl2O3 pứ + (1,5nAl + nSO2 + nS)
=> nAl2O3 = 0,045 mol
Vậy hỗn hợp đầu có : 0,065 mol Al2O3 và 0,23 mol Al
=> m = 12,84g
Đáp án D