Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
Áp dụng định luật bảo toàn mol electron, ta có:
Mà n N O 2 = 3 n H 2 n ê n n e n h ư ờ n g ( 1 ) = n N O 2 n e n h ư ờ n g ( 2 ) = 2 n H 2
Nên ne nhường(1) =3/2 ne nhường(2)
Do đó số mol electron trao đổi ở hai trường hợp là không giống nhau nên R là kim loại có nhiều hóa trị.
Mà kim loại có hóa trị I, II hoặc III.
Kết hợp với
n e n h ư ờ n g ( 1 ) n e n h ư ờ n g ( 2 ) = n R . h o a t r i 1 n p . h o a t r i 2 = 3 2
Ta được R có hóa trị II và III (trong đó R thể hiện hóa trị II khi tác dụng với dung dịch H2SO4 loãng và thể hiện hóa trị III khi tác dụng với dung dịch HNO3 đặc nóng).
Chọn 3 mol R đem hòa tan ban đầu. Khi đó ở các lần thí nghiệm ta thu được 3 mol R(NO3)3 và 3 mol RSO4.
Theo giả thiết ta có:
m R S O 4 = 62 , 81 % m R ( N O 3 ) 2
hay R + 96 = 62,81%(R +186)ÛR = 56ÞR là Fe.
Khi đó, áp dụng định luật bảo toàn moi electron ta có số mol NO2 tạo thành là: n NO2= 3nFe=9
Khi đó lượng oxi đã sử dụng là 9.22,22% = 2
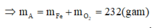
A sẽ chứa một hoặc một số oxit của Fe. Để đơn giản cho quá trình tính toán, coi A là hỗn hợp chứa 3 mol Fe và 4 mol O.
Khi đó trong 20,88 gam A (20,88 = 0,09.232) có 0,27 mol Fe và 0,36 mol O.
nB = 0,03.
Gọi n là số mol electron mà x mol nguyên tử nhận để thu được 1 mol NxOy
Áp dụng định luật bảo toàn mol electron, ta có:
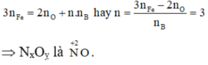
Khi đó:
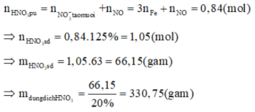

Đáp án C
Áp dụng định luật bảo toàn mol electron, ta có:
Mà nên
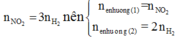
Nên ne nhường(1) = ne nhường(2)
Do đó số mol electron trao đổi ở hai trường hợp là không giống nhau nên R là kim loại có nhiều hóa trị.
Mà kim loại có hóa trị I, II hoặc III.
Kết hợp với
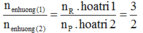
Ta được R có hóa trị II và III (trong đó R thể hiện hóa trị II khi tác dụng với dung dịch H2SO4 loãng và thể hiện hóa trị III khi tác dụng với dung dịch HNO3 đặc nóng).
Chọn 3 mol R đem hòa tan ban đầu. Khi đó ở các lần thí nghiệm ta thu được 3 mol R(NO3)3 và 3 mol RSO4.
Theo giả thiết ta có:
![]()
hay R + 96 = 62,81%(R +186)ÛR = 56ÞR là Fe.
Khi đó, áp dụng định luật bảo toàn moi electron ta có số mol NO2 tạo thành là:
![]()
Khi đó lượng oxi đã sử dụng là 9.22,22% = 2
![]()
A sẽ chứa một hoặc một số oxit của Fe. Để đơn giản cho quá trình tính toán, coi A là hỗn hợp chứa 3 mol Fe và 4 mol O.
Khi đó trong 20,88 gam A (20,88 = 0,09.232) có 0,27 mol Fe và 0,36 mol O.
nB = 0,03.
Gọi n là số mol electron mà x mol nguyên tử N + 5 nhận để thu được 1 mol NxOy
Áp dụng định luật bảo toàn mol electron, ta có:

Þ NxOỵ là .
Khi đó
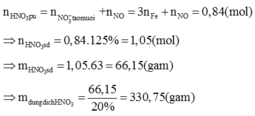

Đáp án D.
nZn = 0,2 (mol),
Giả sử sản phẩm khử chỉ có N2.
Ta có: số mol e nhường = 0,4 < số mol e nhận = 0,2.
Vậy sản phẩm khử phải có NH4NO3.

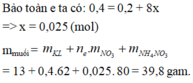

a) \(n_{NO_2}=\dfrac{13,44-11,2}{22,4}=0,1\left(mol\right)\)
Gọi số mol NO là a
\(n_{KMnO_4}=0,1.0,4=0,04\left(mol\right)\)
PTHH: 2NO + O2 --> 2NO2
a------------->a
N+4 -1e--> N+5
a--->a
Mn+7 +5e--> Mn+2
0,04->0,2
Bảo toàn e: a = 0,2 (mol)
=> \(n_{N_2O}=\dfrac{11,2}{22,4}-0,2=0,3\left(mol\right)\)
=> \(n_{NO_2}:n_{NO}:n_{N_2O}=0,1:0,2:0,3=1:2:3\)
31Zn + 80HNO3 --> 31Zn(NO3)2 + 2NO2 + 4NO + 6N2O + 40H2O
b) nZn = 1,55 (mol)
=> mZn = 1,55.65 = 100,75(g)

X + NaOH dư -> khí mùi khai là NH3 => Trong X có muối NH4NO3
NH4NO3 + NaOH --> NaNO3 + NH3 + H2O
nNH3 = 0,28:22,4=0,0125 mol = nNH4NO3
ZnNO3 tan hết trong NaOH dư, 2,9 gam kết tủa là Mg(OH)2
nMg(OH)2 = 0,05 mol , BTNT Mg => nMg = 0,05 mol
<=> mZn = 7,7-0,05.24 = 6,5 gam <=> nZn = 6,5:65 = 0,1 mol
=> %mZn = \(\dfrac{6,5}{7,7}.100\%\)= 84,5%
Mg0 ---> Mg+2 + 2e 2N+5 + 10e --> N20
0,05 ---> 0,1 10x <----x
Zn0 ---> Mg+2 + 2e N+5 + 8e --> N-3
0,1 ---> 0,2 0,1<----0,0125
Áp dụng ĐLBT eletron => nN2 = (0,1 + 0,2 - 0,1):10 = 0,02 mol
=> V = 0,02.22,4 = 0,448 lít

Này nhé: Quy hh X về hh chỉ gồm: Cu,S. Sau đó bạn đắt mol rồi giải




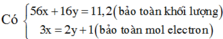
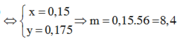
Đáp án A
Các phản ứng xảy ra:
3Fe3O4 + 28HNO3 g 9Fe(NO3)3 + NO + 14H2O
NO + O2 g NO2
2NO2 + O2 + H2O g2HNO3
Trong toàn bộ quá trình, chỉ có nguyên tố Fe và O thay đổi số oxi hóa (nguyên tố N không có sự thay đổi số oxi hóa). Do đó ta có các quá trình nhường và nhận electron như sau: