Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
Áp dụng định luật bảo toàn mol electron, ta có:
Mà n N O 2 = 3 n H 2 n ê n n e n h ư ờ n g ( 1 ) = n N O 2 n e n h ư ờ n g ( 2 ) = 2 n H 2
Nên ne nhường(1) =3/2 ne nhường(2)
Do đó số mol electron trao đổi ở hai trường hợp là không giống nhau nên R là kim loại có nhiều hóa trị.
Mà kim loại có hóa trị I, II hoặc III.
Kết hợp với
n e n h ư ờ n g ( 1 ) n e n h ư ờ n g ( 2 ) = n R . h o a t r i 1 n p . h o a t r i 2 = 3 2
Ta được R có hóa trị II và III (trong đó R thể hiện hóa trị II khi tác dụng với dung dịch H2SO4 loãng và thể hiện hóa trị III khi tác dụng với dung dịch HNO3 đặc nóng).
Chọn 3 mol R đem hòa tan ban đầu. Khi đó ở các lần thí nghiệm ta thu được 3 mol R(NO3)3 và 3 mol RSO4.
Theo giả thiết ta có:
m R S O 4 = 62 , 81 % m R ( N O 3 ) 2
hay R + 96 = 62,81%(R +186)ÛR = 56ÞR là Fe.
Khi đó, áp dụng định luật bảo toàn moi electron ta có số mol NO2 tạo thành là: n NO2= 3nFe=9
Khi đó lượng oxi đã sử dụng là 9.22,22% = 2
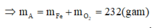
A sẽ chứa một hoặc một số oxit của Fe. Để đơn giản cho quá trình tính toán, coi A là hỗn hợp chứa 3 mol Fe và 4 mol O.
Khi đó trong 20,88 gam A (20,88 = 0,09.232) có 0,27 mol Fe và 0,36 mol O.
nB = 0,03.
Gọi n là số mol electron mà x mol nguyên tử nhận để thu được 1 mol NxOy
Áp dụng định luật bảo toàn mol electron, ta có:
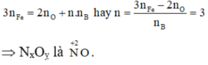
Khi đó:
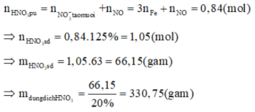

a)
\(n_{O_2\left(pư\right)}=\dfrac{16,6-15}{32}=0,05\left(mol\right)\)
Bảo toàn O: nH2O = 0,1 (mol)
Bảo toàn H: nH2SO4 = 0,1 (mol)
=> \(V_{dd.H_2SO_4}=\dfrac{0,1}{0,2}=0,5\left(l\right)\)
b)
Theo ĐLBTKL: moxit + mH2SO4 = mmuối + mH2O
=> 16,6 + 0,1.98 = mmuối + 0,1.18
=> mmuối = 24,6 (g)

Đáp án A
Các phản ứng xảy ra:
3Fe3O4 + 28HNO3 g 9Fe(NO3)3 + NO + 14H2O
NO + O2 g NO2
2NO2 + O2 + H2O g2HNO3
Trong toàn bộ quá trình, chỉ có nguyên tố Fe và O thay đổi số oxi hóa (nguyên tố N không có sự thay đổi số oxi hóa). Do đó ta có các quá trình nhường và nhận electron như sau:


Trong G dùng phương pháp đường chéo
ta được
NO2 ( amol) 13,42
30,58
N2O4 ( b mol) 2,58 ( thêm mũi tên chỉ xuống chỉ lên hộ)
Ta có:
a:b = 1:1 và a + b =0,06
=> a = b =0,03
Theo định luật bảo toàn electron
\(n_{enhận}=0,09\left(mol\right)\Rightarrow n_M=\dfrac{0,09}{n}\)
\(\Rightarrow M=18,67n\) khi n = 3
thì M là 56 ( M là Fe)
-Oxit sắt có chứa 27,59% oxi nên đó là Fe3O4
- cho Zn vào dd B , xảy ra pứ:
\(4Zn+NO^-_3+7OH^-\rightarrow4ZnO_4^-+NH_3+2H_2O\left(1\right)\)
Và : \(Zn+2OH^-\rightarrow ZnO^{2-}_2+H_2\left(2\right)\)
=> nZn = 0,37 (mol)
Theo định luật bảo toàn:
nNH3 = 0,09 => nZn (1)
= 0,36 (mol) ; nZn (2) = 0,01 (mol)
=> nH2 = 0,01 (mol) , VH2 = 2,24 (lít)


Để lượng kết tủa không đổi thì KOH cần tối thiểu là vừa đủ để hoà tan hết A l ( O H ) 3 . Tổng số mol KOH là: 0,13 + 0,1 + 0,3 + 0,9 + 0,3 = 1,73 mol
Thể tích dung dịch KOH là: 1,73 : 5 = 0,346 lít = 346 ml

\(Đặt:n_A=x\left(mol\right),n_{NO}=a\left(mol\right),n_{NO_2}=b\left(mol\right)\)
\(Giảsử:n_{khí}=1\left(mol\right)\)
\(\Rightarrow a+b=1\left(mol\right)\left(1\right)\)
\(\overline{M_{khí}}=\dfrac{30a+46b}{a+b}=20\cdot2\)
\(\Leftrightarrow30a+46b=40\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.375,b=0.625\)
\(BTe:2n_A=3n_{NO}+n_{NO_2}\Rightarrow n_A=\dfrac{3\cdot0.375+0.625}{2}=0.875\left(mol\right)\)
\(m_{A\left(NO_3\right)_2}=0.875\cdot\left(A+124\right)=66.15\left(g\right)\\ \Rightarrow A=\)
Đến đây bạn xem lại đề nhé.

\(Fe+2HCl\rightarrow FeCl_2+H_2\\ n_{Fe}=n_{H_2}=\dfrac{0,448}{22,4}=0,02\left(mol\right)\\ a,\%m_{Fe}=\dfrac{0,02.56}{4,36}.100\approx25,688\%\\ \Rightarrow\%m_{Ag}\approx74,312\%\\ b,Ta.thấy:2,18=\dfrac{1}{2}.4,36\\ \Rightarrow m_{hh\left(câuB\right)}=\dfrac{1}{2}.m_{hh\left(câuA\right)}\\ n_{Fe}=\dfrac{0,02}{2}=0,01\left(mol\right)\\ n_{Ag}=\dfrac{2,18-0,01.56}{108}=0,015\left(mol\right)\\ 2Fe+3Cl_2\rightarrow\left(t^o\right)2FeCl_3\\ 2Ag+Cl_2\rightarrow\left(t^o\right)2AgCl\\ n_{Cl_2}=\dfrac{3}{2}.n_{Fe}+\dfrac{1}{2}.n_{Ag}=\dfrac{3}{2}.0,01+\dfrac{1}{2}.0,015=0,0225\left(mol\right)\\ \Rightarrow V_{Cl_2\left(đktc\right)}=0,0225.22,4=0,504\left(l\right)\)

a) 2Al + 6HCl -> 2AlCl3 + 3H2
b)nAl = 2.7/27=0.1mol
2Al + 6HCl -> 2AlCl3 + 3H2
(mol) 0.1 0.3 0.1 0.15
VH2 = 0.15*22.4=3.36l
mAlCl3= 0.1*133.5=13.35g
=>C%=\(\dfrac{13,35}{500+27}100=2,533\%\)
Bạn có thể giúp mình thêm phương trình hoá học của phản ứng đấy được không
Đáp án C
Áp dụng định luật bảo toàn mol electron, ta có:
Mà nên
Nên ne nhường(1) = ne nhường(2)
Do đó số mol electron trao đổi ở hai trường hợp là không giống nhau nên R là kim loại có nhiều hóa trị.
Mà kim loại có hóa trị I, II hoặc III.
Kết hợp với
Ta được R có hóa trị II và III (trong đó R thể hiện hóa trị II khi tác dụng với dung dịch H2SO4 loãng và thể hiện hóa trị III khi tác dụng với dung dịch HNO3 đặc nóng).
Chọn 3 mol R đem hòa tan ban đầu. Khi đó ở các lần thí nghiệm ta thu được 3 mol R(NO3)3 và 3 mol RSO4.
Theo giả thiết ta có:
hay R + 96 = 62,81%(R +186)ÛR = 56ÞR là Fe.
Khi đó, áp dụng định luật bảo toàn moi electron ta có số mol NO2 tạo thành là:
Khi đó lượng oxi đã sử dụng là 9.22,22% = 2
A sẽ chứa một hoặc một số oxit của Fe. Để đơn giản cho quá trình tính toán, coi A là hỗn hợp chứa 3 mol Fe và 4 mol O.
Khi đó trong 20,88 gam A (20,88 = 0,09.232) có 0,27 mol Fe và 0,36 mol O.
nB = 0,03.
Gọi n là số mol electron mà x mol nguyên tử N + 5 nhận để thu được 1 mol NxOy
Áp dụng định luật bảo toàn mol electron, ta có:
Þ NxOỵ là .
Khi đó