Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
nAl = 0,06 mol ; nHNO3 = 0,28 mol
=> Sau phản ứng : nAl3+ = 0,06 mol ; nH+ = 0,04 mol
Trộn A và B có kết tủa => Trong B còn OH- (HCl hết)
+) Giả sử phản ứng tạo kết tủa Al(OH)3 sau đó tan 1 phần
=> nAl(OH)3 = 4nAl3+ - nOH-
=> nOH- = 4.0,06 - 1,56/78=0,22 mol
=> nOH- (B) = 0,22 + 0,04trung hòa = 0,26 mol > 2nH2 = 2.0,125 = 0,25 mol
=> Phản ứng tạo kết tủa và Al3+ dư
=> nOH - = nH+ +3nAl(OH)3 = 0,1 mol
=> nH2 (do H+) = 0,125 - 1/2.0,1 = 0,075 mol
=> nHCl = 0,15 mol => a = 0,3 lít

Chọn A.
Dung dịch A gồm Al(NO3)3 (0,06 mol) và HNO3 dư (0,04 mol)
Dung dịch B gồm M+, Cl- (0,5a mol) và OH- với
![]()
Khi cho A tác dụng với B thì kết tủa đang hình thành và chưa đạt cực đại
![]()

Đáp án : B
nAl = 0,06 mol ; nHNO3 = 0,28 mol
Al + 4HNO3 à Al(NO3)3 + NO + 2H2O
=> nAl3+ = 0,06 mol ; nH+ dư = 0,04 mol
. Khi trộn X vào Y thì thu được kết tủa chính là Al(OH)3 => nAl(OH)3 = 0,02 mol
+) TH1 : Al3+ dư => nNaOH = 3nAl3+ pứ + nH+ = 3nAl(OH)3 + nH+ = 0,1 mol < 0,25 = nNa
Xét dung dịch X ta có : nNaOH = nNa ban đầu – nHCl => nHCl = 0,15 mol
=> CM(HCl) = 0,3M ( Có đáp án thỏa mãn )

Chọn đáp án A
4H+ + NO3– + 3e → NO + 2H2O ⇒ nH+ dư = 4nNO = 0,06 mol.
Bảo toàn nguyên tố Hidro: nH2O = (0,66 - 0,06 - 0,075 × 2) ÷ 2 = 0,225 mol.
Quy hỗn hợp ban đầu về Fe và O ⇒ nO = nH2O = 0,225 mol.
⇒ nFe = (17,04 - 0,225 × 16) ÷ 56 = 0,24 mol. Bảo toàn electron cả quá trình:
3nFe = 2nO + 2nH2 + 3nNO + nAg ⇒ nAg = 0,075 mol.
► Kết tủa gồm 0,075 mol Ag và 0,66 mol AgCl
⇒ m = 0,075 × 108 + 0,66 × 143,5 = 102,81(g) ⇒ chọn A
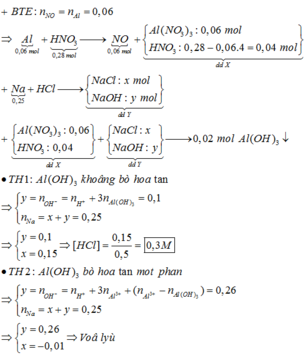





Đáp án D