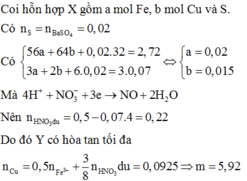Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
Quy đổi hỗn hợp về Fe (x mol); Cu (y mol) và S (z mol)
Bảo toàn S có
nS = n↓ = 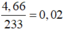 (mol)
(mol)
mX = 2,72 gam → 56x + 64y + 0,02.32 = 2,72 → 56x + 64y = 2,08 (1)
Do Y có thể hòa tan được Cu, bảo toàn electron có:
3.nFe + 2.nCu + 6.nS = 3.0,07 → 3x + 2y = 0,09 (2)
Từ (1) và (2) có: x = 0,02 và y = 0,015.
Dung dịch Y gồm: Fe3+: 0,02 mol; Cu2+: 0,015 mol; SO42- = 0,02 mol; NO3- = (0,5 – 0,07 = 0,43 mol) và có thể có H+
Bảo toàn điện tích → nH+ = 0,38 mol
Cho Cu vào Y có phản ứng:
3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO + 4H2O
0,1425 ← 0,38 0,43 mol
Cu + 2Fe3+ → Cu2+ + 2Fe2+
0,01 ← 0,02 mol
m = (0,01 + 0,1425).64 = 9,76 gam.

Ta có: \(m_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\) \(\Rightarrow m_{H_2}=0,2\cdot2=0,4\left(g\right)\)
\(\Rightarrow m_{dd\left(sau.pư\right)}=m_{hh}+m_{ddH_2SO_4}-m_{H_2}=309,6\left(g\right)\)
\(\Rightarrow a=309,6-300=9,6\left(g\right)\)

$a)PTHH:2Al+6HCl\to 2AlCl_3+3H_2$
$n_{H_2}=\dfrac{5,04}{22,4}=0,225(mol)$
$\Rightarrow n_{Al}=0,15(mol)$
$\Rightarrow \%m_{Al}=\dfrac{0,15.27}{9,45}.100\%\approx 42,86\%$
$\Rightarrow \%m_{Cu}=100-42,86=57,14\%$
$b)$ Theo PT: $n_{HCl}=2n_{H_2}=0,45(mol)$
$\Rightarrow C_{M_{HCl}}=\dfrac{0,45.110\%}{0,5}=0,99M$

Quy đổi hỗn hợp kim loại thành R, có soh là +n
\(n_R=\dfrac{17,1}{M_R}\left(mol\right)\)
R0 - ne --> R+n
\(\dfrac{17,1}{M_R}\)->\(\dfrac{17,1n}{M_R}\)
S+6 + 2e --> S+4
1<---0,5
Bảo toàn e: \(\dfrac{17,1n}{M_R}=1\Rightarrow M_R=17,1n\)
Muối thu được có CTHH là R2(SO4)n
\(n_{R_2\left(SO_4\right)_n}=\dfrac{17,1}{2.M_R}\left(mol\right)\)
=> \(m_{R_2\left(SO_4\right)_n}=\dfrac{17,1}{2.M_R}\left(2.M_R+96n\right)=17,1+\dfrac{820,8n}{M_R}=65,1\left(g\right)\)

a. Gọi \(a,b\) lần lượt là số mol của \(Mg,Fe\) có trong hỗn hợp ban đầu.
\(\Rightarrow m_{hh}=24a+56b=22,8\left(g\right)\left(1\right)\)
\(n_{SO_2}=\frac{15,68}{22,4}=0,7\left(mol\right)\)
Các quá trình oxi hóa và khử:
\(Mg\rightarrow Mg^{2+}+2e\)
\(a----->2a\)
\(Fe\rightarrow Fe^{3+}+3e\)
\(b----->3b\)
\(S^{+6}+2e\rightarrow S^{+4}\)
\(0,7-1,4-0,7\)
Áp dung định luật bào toàn electron, ta có: \(2a+3b=1,4\left(mol\right)\left(2\right)\)
Từ \(\left(1\right),\left(2\right)\) ta được hệ: \(\left\{{}\begin{matrix}24a+56b=22,8\\2a+3b=1,4\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,25\left(mol\right)\\b=0,3\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{Mg}=0,25.24=6\left(g\right)\Rightarrow\%m_{Mg}=\frac{6}{22,8}=.100\%=26,32\%\)
\(\Rightarrow\%m_{Fe}=100\%-26,32\%=73,68\%\)
b. Từ câu a, ta được: \(n_{H_2SO_4\left(p.ư\right)}=n_{S^{+6}}=0,7\left(mol\right)\)
\(n_{NaOH}=0,4.3=1,2\left(mol\right)\)
PTHH: \(H_2SO_4+2NaOH\rightarrow Na_2SO_4+2H_2O\)
\(\Rightarrow n_{H_2SO_4\left(dư\right)}=\frac{1,2}{2}=0,6\left(mol\right)\)
\(\Rightarrow n_{H_2SO_4\left(bđ\right)}=0,7+0,6=1,3\left(mol\right)\)
\(\Rightarrow m_{H_2SO_4\left(bđ\right)}=1,3.98=127,4\left(g\right)\)
\(\Rightarrow m_{ddH_2SO_4\left(bđ\right)}=\frac{127,4.100}{98}=130\left(g\right)\)
c. Gọi \(x\) là số mol của \(Cu_2S\) \(\rightarrow n_{FeS_2}=2x\left(mol\right)\)
PTHH:
\(2FeS_2+14H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+14H_2O+15SO_2\)
\(2x---->14x-->x\)
\(Cu_2S+6H_2SO_4\rightarrow2CuSO_4+5SO_2+6H_2O\)
\(x---->6x-->2x\)
\(\Rightarrow14x+6x=1,3\left(mol\right)\Leftrightarrow x=0,065\left(mol\right)\)
\(\Rightarrow n_{Fe_2\left(SO_4\right)_3}=x=0,065\left(mol\right);n_{CuSO_4}=2x=0,13\left(mol\right)\)
\(\Rightarrow m_{Fe_2\left(SO_4\right)_3}=0,065.400=26\left(g\right);m_{CuSO_4}=0,13.160=20,8\left(g\right)\)
\(\Rightarrow m\)muối\(=26+20,8=46,8\left(g\right)\)

Đề chưa nói rõ là : tác dụng với dung dịch axit nào nên có lẽ là HCl hoặc H2SO4 , thứ hai là câu c không đủ dữ kiện đề bài để giải nhé.
\(Đặt:n_{Mg}=x\left(mol\right),n_{Fe}=y\left(mol\right)\)
\(m_{hh}=24x+56y=8\left(g\right)\left(1\right)\)
\(Mg+2HCl\rightarrow MgCl_2+H_2\\ Fe+2HCl\rightarrow FeCl_2+H_2\)
\(n_{H_2}=x+y=0.2\left(mol\right)\left(2\right)\)
\(\left(1\right),\left(2\right):x=y=0.1\)
\(\%Mg=\dfrac{0.1\cdot24}{8}\cdot100\%=30\%\\ \%Fe=70\%\)
\(m_M=m_{MgCl_2}+m_{FeCl_2}=0.1\cdot95+0.1\cdot127=22.2\left(g\right)\)