Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Quy đổi hỗn hợp thành Fe và O với số mol là x và y → 56x + 16y =17,04 g
nNO =0,015 mol → nH+(A)=0,06 mol
Bảo toàn số mol H+ có nHCl = 2nH2 +2nO + nH+(A) → nO= y=(0,66 -0,06-2.0,075):2=0,225 mol
→ x =0,24 mol
Khi cho AgNO3 vào dd A thì tạo ↓ AgCl và Ag
Bảo toàn số mol Cl thì AgCl : 0,66 mol
Bảo toàn e cho toàn bộ quá trình thì 3x =2.0,075 + 2.0,225 +3.0,015+ nAg→ nAg=0,075 mol
→ m =0,075.108 +0,66 .143,5=102,81 g

H2SO4 dùng dư đề cho rõ ràng nhé → 21,4 gam kết tủa rõ là 0,2 mol Fe(OH)3.
mà có 0,9 mol NaOH → chứng tỏ nH+ trong Y = 0,3 mol. hết.!
(p/s: đừng nhầm lẫn 0,2 mol Fe(OH)3 → ∑nFe trong X = 0,2 luôn nhé.!).
♦ CB3: 19,2 gam (Fe; O) + 0,75 mol H2SO4 (lượng đủ) → Fe2(SO4)3 + SO2 + H2O.
có 2x mol Fe → x mol Fe2(SO4)3
→ nSO2 = 0,75 – 3x theo bảo toàn S.
bảo toàn electron có 2nO trong X = 3nFe – 2nSO2
→ nO trong X = 6x – 0,75 mol
||→ mX = mFe + mO = 56 × 2x + 16 × (6x – 0,75) = 19,2
→ giải ra: x = 0,15 mol.
→ nSO2 = 0,75 – x = 0,3 mol → Yêu cầu VSO2 = 6,72 lít.
p/s: giải CB3 có khá nhiều hướng khác: ví dụ gọi x như trên thì có SO2 theo x;
nH2O = 0,375 mol → BTKL cả phương trình giải ra x luôn.!
Đáp án B

Đáp án B
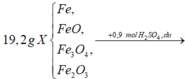
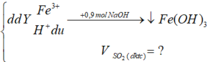
nH+ du = nNaOH - 3nFe(OH)3
=0,9 - 3.0,2 =0,3 mol
=> nH2SO4 dư = 0,3/2 = 0,15 (mol)
Coi hỗn hợp X ban đầu gồm Fe: x mol và O: y mol
Gọi nSO2 = z mol



Sau khi hỗn hợp X bị CO lấy đi 1 phần oxi ⇒ Chất rắn Y.
+ Đặt nFe/Y = a và nO/Y = b ta có:
PT bảo toàn electron: 3a – 2b = 2nSO2 = 0,09 mol (1)
PT theo muối Fe2(SO4)3: 200a = 18 (2)
+ Giải hệ (1) và (2) ta có: a = b = 0,09 mol
⇒ mY = 0,09×(56+16) = 6,48 gam.
+ Mà nO bị lấy đi bởi CO = nCaCO3 = 0,04 mol
⇒ nX = mY + mO bị lấy đi = 6,48 + 0,04×16 = 7,12 gam
Đáp án B

Bạn bấn vào đây, có người hỏi bài này rồi nhá Câu hỏi của Mạc Nhược Ca - Hóa học lớp 12 | Học trực tuyến

