
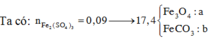
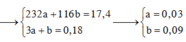
![]()
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

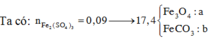
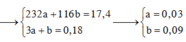
![]()

H2SO4 dùng dư đề cho rõ ràng nhé → 21,4 gam kết tủa rõ là 0,2 mol Fe(OH)3.
mà có 0,9 mol NaOH → chứng tỏ nH+ trong Y = 0,3 mol. hết.!
(p/s: đừng nhầm lẫn 0,2 mol Fe(OH)3 → ∑nFe trong X = 0,2 luôn nhé.!).
♦ CB3: 19,2 gam (Fe; O) + 0,75 mol H2SO4 (lượng đủ) → Fe2(SO4)3 + SO2 + H2O.
có 2x mol Fe → x mol Fe2(SO4)3
→ nSO2 = 0,75 – 3x theo bảo toàn S.
bảo toàn electron có 2nO trong X = 3nFe – 2nSO2
→ nO trong X = 6x – 0,75 mol
||→ mX = mFe + mO = 56 × 2x + 16 × (6x – 0,75) = 19,2
→ giải ra: x = 0,15 mol.
→ nSO2 = 0,75 – x = 0,3 mol → Yêu cầu VSO2 = 6,72 lít.
p/s: giải CB3 có khá nhiều hướng khác: ví dụ gọi x như trên thì có SO2 theo x;
nH2O = 0,375 mol → BTKL cả phương trình giải ra x luôn.!
Đáp án B

Đáp án B
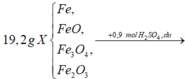
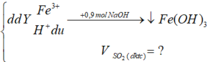
nH+ du = nNaOH - 3nFe(OH)3
=0,9 - 3.0,2 =0,3 mol
=> nH2SO4 dư = 0,3/2 = 0,15 (mol)
Coi hỗn hợp X ban đầu gồm Fe: x mol và O: y mol
Gọi nSO2 = z mol



Đáp án C
X + CO tạo thành chất rắn Y gồm các kim loại Mg, Fe, Cu và hỗn hợp khí z gồm CO2 và CO dư
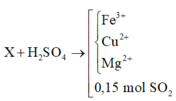
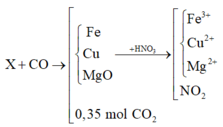
Áp dụng định luật bảo toàn mol electron
Trong thí nghiệm 1: ne nhường = ne nhận = 0,3(mol)
ne nhường trong thí nghiệm = ne nhường (1) + 2.nCO2 =1(mol) = ne nhận (2) = nNO2
Chú ý: Với các bài toán của phản ứng oxi hoá khử gồm nhiều quá trình ta thường sử dụng bảo toàn electron cho toàn bộ các quá trình, bỏ qua giai đoạn trung gian.

Sau khi hỗn hợp X bị CO lấy đi 1 phần oxi ⇒ Chất rắn Y.
+ Đặt nFe/Y = a và nO/Y = b ta có:
PT bảo toàn electron: 3a – 2b = 2nSO2 = 0,09 mol (1)
PT theo muối Fe2(SO4)3: 200a = 18 (2)
+ Giải hệ (1) và (2) ta có: a = b = 0,09 mol
⇒ mY = 0,09×(56+16) = 6,48 gam.
+ Mà nO bị lấy đi bởi CO = nCaCO3 = 0,04 mol
⇒ nX = mY + mO bị lấy đi = 6,48 + 0,04×16 = 7,12 gam
Đáp án B

Đáp án B.
![]()
Giả sử Z + H2SO4 → dung dịch muối tạo thành chỉ có Fe2(SO4)3:
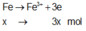
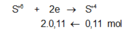
![]()
![]()
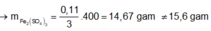
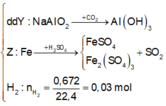
→ muối thu được gồm FeSO4 và Fe2(SO4)3.
Ta có sơ đồ phản ứng:
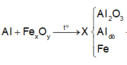
→ + N a O H d ư

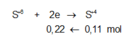
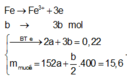
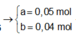
![]()
X tác dụng được với dung dịch NaOH tạo khí H2 →Al dư.
![]()
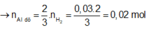
![]()
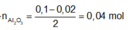
![]()
![]()
![]()
![]()

X + NaOH ⟶3/2 H2; nA1 = 0,02
CO2 + NaAlO2 + H2O ⟶ NaHCO3 + Al(OH)3
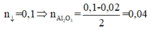
⇒ m = 10,26g
Đáp án A