Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Trong phòng thí nghiệm, quá trình điều chế khí Z thường bị lẫn SO2 nên Z là C2H4.
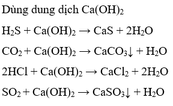
Vậy để tách SO2 ra khỏi hỗn hợp C2H4 và SO2 ta có thể dùng các chất: Ca(OH)2, K2SO3.
PTHH:
SO2 + Ca(OH)2 → CaSO3↓ + H2O
K2SO3 + SO2 + H2O → 2KHSO3

(a) Từ hình ảnh bộ dụng cụ ta thấy đây là bộ dụng cụ để điều chế các khí không tác dụng được với nước, và không tan hoặc rất ít tan trong nước
=> khí C có thể điều chế được là các khí: H2, C2H2, SO2
Cl2 và HCl không điều chế được vì tan trong nước
CO không điều chế được bằng bộ dụng cụ này trong phòng thí nghiệm.
(b)
Điều chế: H2 ; A có thể là HCl hoặc H2SO4 loãng ; B là có thể là kim loại Zn, Fe…
2HCl + Zn → ZnCl2 + H2↑
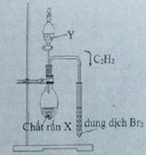
Điều chế: C2H2; A là H2O ; B là CaC2 rắn
2H2O + CaC2 → Ca(OH)2 + C2H2↑
Điều chế: SO2 ; A là HCl ; B là Na2SO3 rắn
2HCl + Na2SO3 → 2NaCl + SO2↑ + H2O

Chọn X: H2 ; Y : O2 ; Z: C2H2
Zn + 2HCl → ZnCl2 + H2
2KMnO4 →K2MnO4 + MnO2 + O2
CaC2 + 2H2O → Ca(OH)2 + C2H2

a. Khí O2 ít tan trong nước và nặng hơn không khí nên cách 1b không được (khi đó không khí sẽ xua hết khí O2 ra ngoài), trong phòng thí nghiệm người ta sử dụng cách 1a
b. Điều chế khí O2 người ta nhiệt phân các hợp chất giàu oxi: KMnO4; KClO3
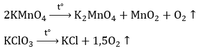

- Phương pháp điều chế clo trong phòng thí nghiệm: Đun nóng nhẹ dung dịch HCl đậm đặc với chất oxi hóa mạnh như MnO2 (hoặc KMnO4).
MnO2 + 4HCl \(\underrightarrow{t^o}\) MnCl2 + Cl2 + 2H2O
Để thu được khí clo tinh khiết:
- Bình H2SO4 đặc có tác dụng làm khô khí clo.
- Clo nặng hơn không khí Þ Thu bằng cách đẩy không khí.
- Bông tẩm xút: tránh để clo độc bay ra ngoài.

(X, Y) = (CaC2; H2O)
CH≡CH + Br2 → CH(Br2)–CH(Br2)
Dung dịch Br2 nâu đỏ dần nhạt màu rồi mất màu hoàn toàn
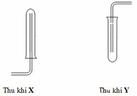

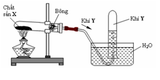
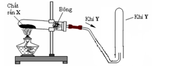
Z có thể là $H_2$
X : $H_2SO_4$
Y : $Mg$
PTHH :
$Mg + H_2SO_4 \to MgSO_4 + H_2$