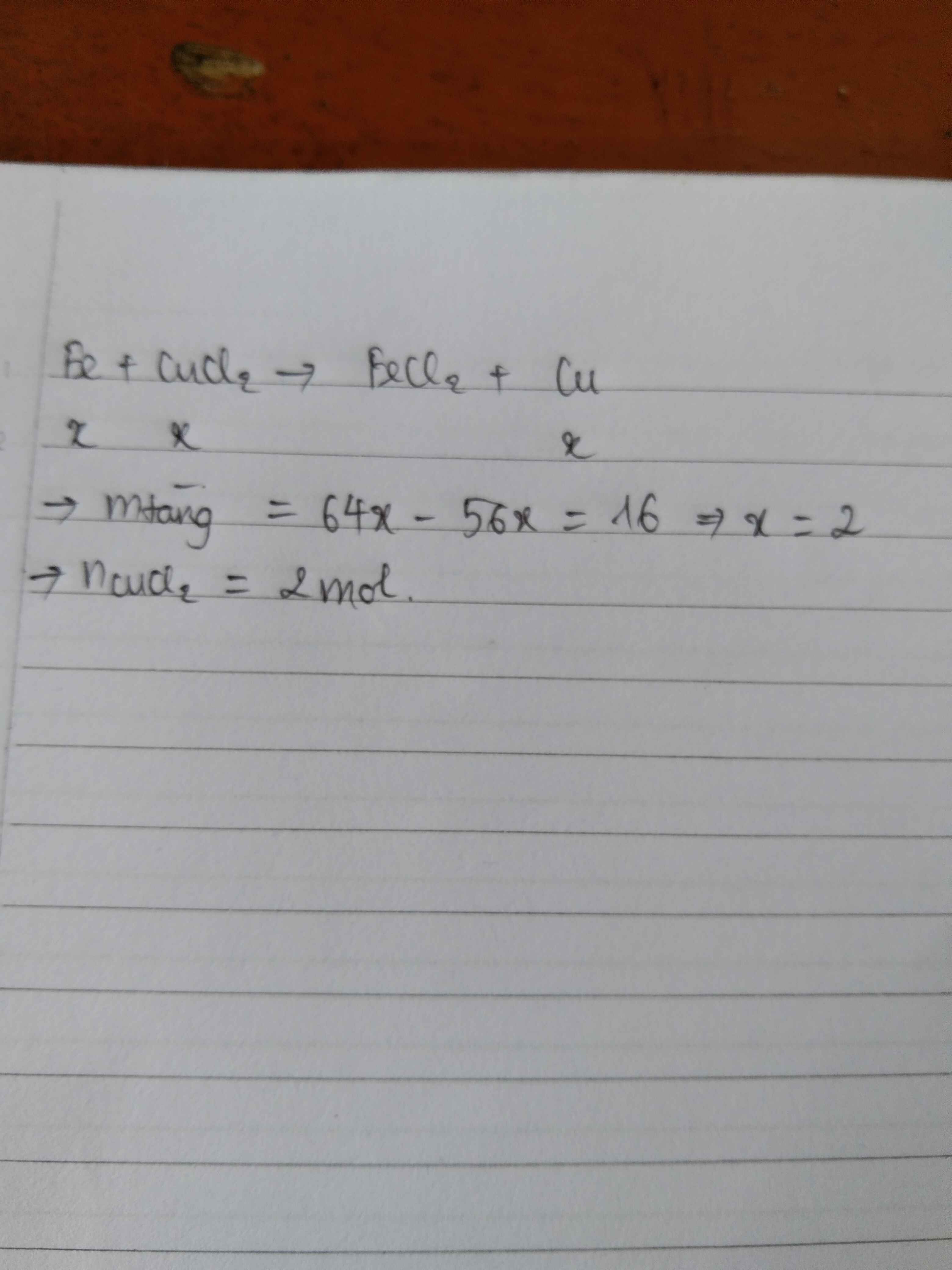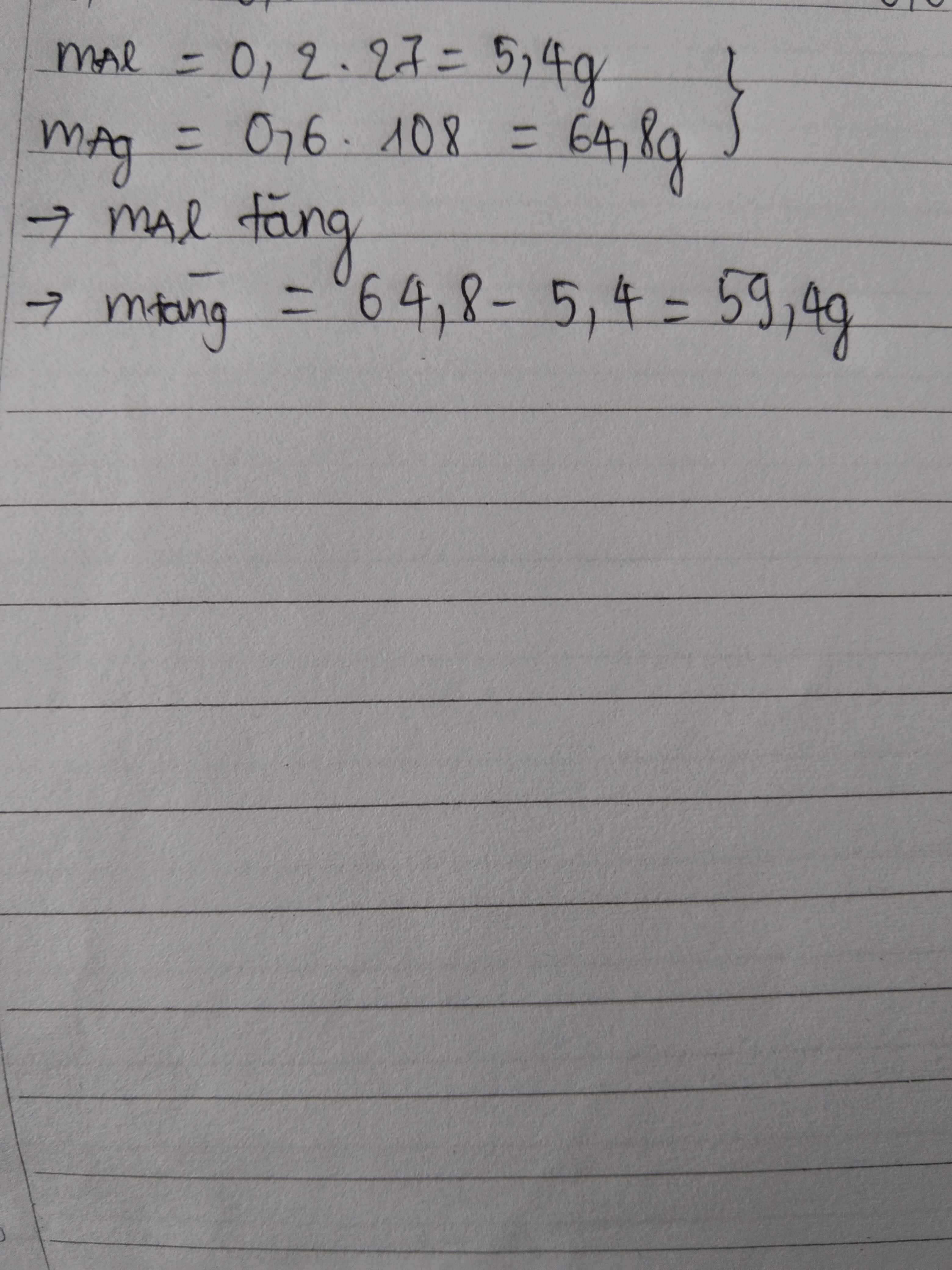Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giả sử thanh kim loại ban đầu nặng m (g)
Gọi số mol Cu(NO3)2, Pb(NO3)2 pư là a (mol)
TN1:
PTHH: R + Cu(NO3)2 --> R(NO3)2 + Cu
a<-------a------------------>a
=> mgiảm = a.MR - 64a (g)
Và \(m_{giảm}=\dfrac{0,05m}{100}=0,0005m\left(g\right)\)
=> \(a.M_R-64a=0,0005m\) (1)
TN2:
PTHH: R + Pb(NO3)2 --> R(NO3)2 + Pb
a<-------a------------------->a
=> mtăng = 207a - a.MR (g)
Và \(m_{tăng}=\dfrac{7,1.m}{100}=0,071m\left(g\right)\)
=> \(207a-a.M_R=0,071m\) (2)
(1)(2) => \(\dfrac{M_R-64}{207-M_R}=\dfrac{0,0005}{0,071}\)
=> MR = 65 (g/mol)
=> R là Zn

Gọi số mol Fe phản ứng là a (mol)
PTHH: Fe + CuSO4 --> FeSO4 + Cu
a------------------->a----->a
=> 50 - 56a + 64a = 51
=> a = 0,125 (mol)
=> \(n_{FeSO_4}=0,125\left(mol\right)\)
=> \(m_{FeSO_4}=0,125.152=19\left(g\right)\)
\(Đặt:n_{Fe\left(pứ\right)}=x\left(mol\right)\\ Fe+CuSO_4\rightarrow FeSO_4+Cu\\m_{tăng}=m_{Cu}-m_{Fe\left(pứ\right)}=51-50\\ \Leftrightarrow 64x-56x=1\\ \Rightarrow x=0,125\left(mol\right)\\ n_{FeSO_4}=n_{Fe}=0,125\left(mol\right)\\ \Rightarrow m_{FeSO_4}=0,125.152=19\left(g\right)\)

\(m_{giảm} =m_{R\ pư}= 50.3,25\% = 1,625(gam) \\ \text{Gọi n là hóa trị của kim loại R}\\ 2R + 2nHCl \to 2RCl_n + nH_2\\ n_{H_2} = \dfrac{0,56}{22,4} = 0,025(mol) \Rightarrow n_R = \dfrac{2}{n}n_{H_2} = \dfrac{0,05}{n}(mol)\\ \Rightarrow \dfrac{0,05}{n}.R = 1,625 \Rightarrow R = \dfrac{65}{2}n\)
Với n = 2 thì R = 65(Zn)
Vậy R là kim loại kẽm

a) đặt a,b,c là số mol của Al,Fe,Cu trong 3,31 g X
mX = 27a + 56b + 64c = 3,31 (1)
mH2 = 15a + b = 0,035 (2)
dặt ka , kb , kc là số mol của Al,Fe,Cu trong 0,12 mol Y
nX = ka + kb + kc= 0,12 (3)
mY = 133,5ka + 162,5kb + 135kc = 17,27(4)
(3)/(4) triệt tiêu nhau còn lại k, kết hợp (1)(2) được:
a = 0,01
b= 0,02
c= 0,03
=> % lần lượt là 8,16%, 33,84% , 58%