Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

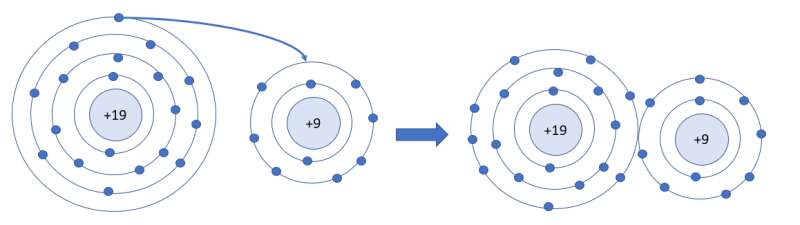
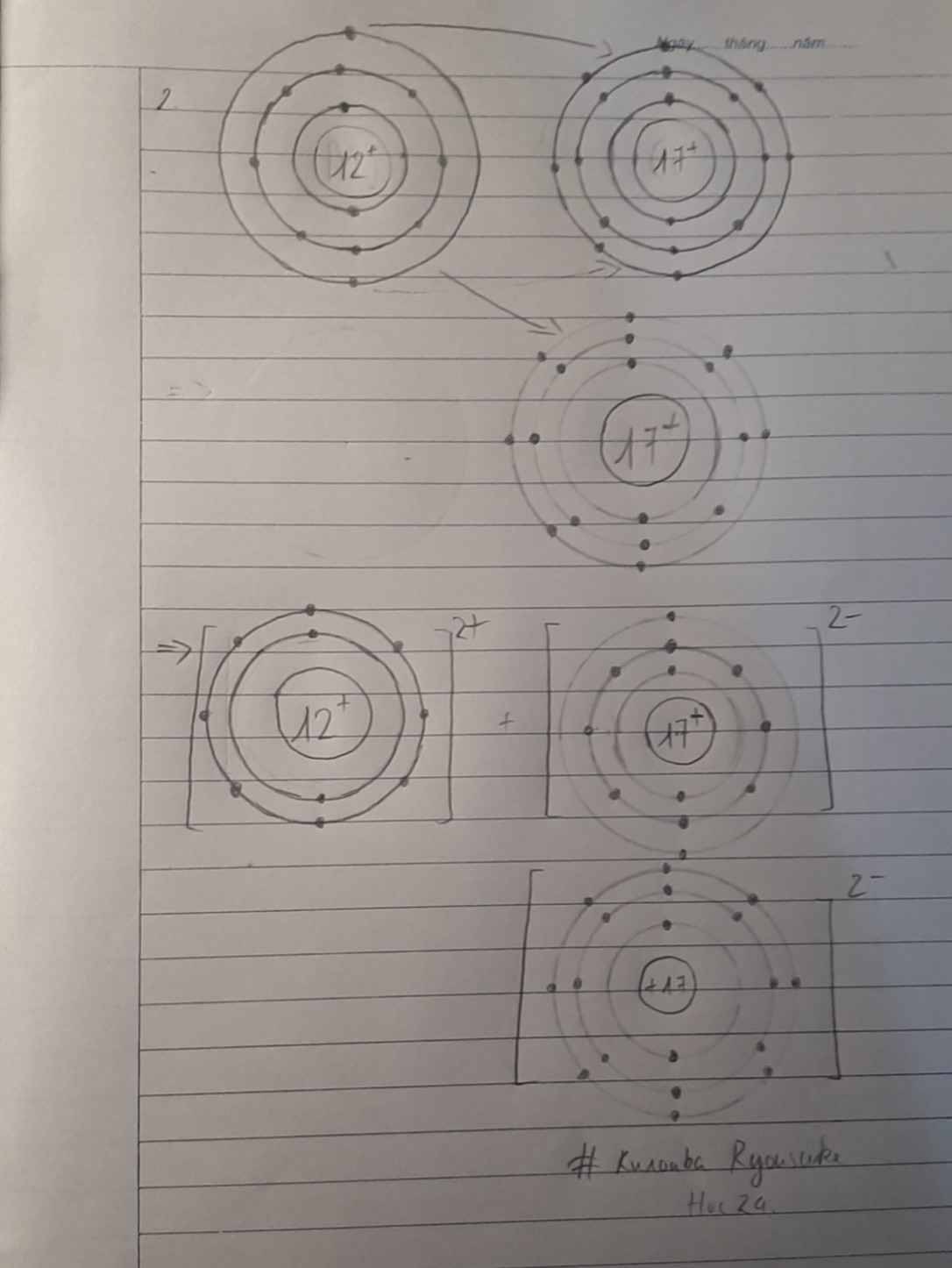
- Ca có 2 electron ở lớp ngoài cùng (giống như nguyên tử Mg) => Dễ dàng cho đi 2 electron ở lớp ngoài cùng để tạo cấu hình electron bền vững của khí hiếm
- O có 6 electron ở lớp ngoài cùng => Dễ dàng nhận thêm 2 electron ở lớp ngoài cùng để tạo cấu hình electron bền vững của khí hiếm
Cái sơ đồ em vẽ vòng e của 2 nguyên tử dùng dấu + xong -> thành 2 vòng e các nguyên tử sát nhau

K cho đi 1e để nhận được cấu hình khí hiếm
Tham khảo

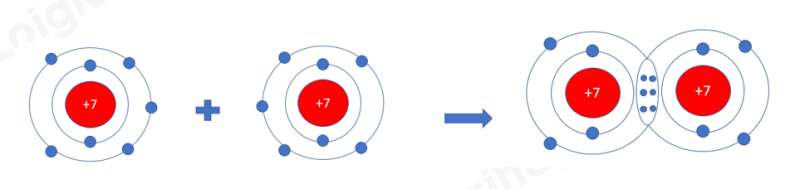
Vì mỗi nguyên tử N đều có 5 electron ở lớp vỏ ngoài cùng => Cần nhận thêm 3 electron vào lớp vỏ ngoài cùng để có lớp vỏ electron bền vững tương tự khí hiếm
=> Khi 2 nguyên tử N liên kết với nhau, mỗi nguyên tử sẽ góp 3 electron ở tạo ra 3 đôi electron dùng chung

- Nguyên tử N nằm ở ô số 7, nhóm VA => Có 5 electron ở lớp ngoài cùng, cần 3 electron để đạt cấu hình khí hiếm
- Nguyên tử C nằm ở ô số 6, nhóm IVA => Có 4 electron ở lớp ngoài cùng, cần 4 electron để đạt cấu hình khí hiếm
- Nguyên tử O nằm ở ô số 8, nhóm VIA => Có 6 electron ở lớp ngoài cùng, cần 2 electron để đạt cấu hình khí hiếm
a) Xét phân tử Nitrogen: gồm 2 nguyên tử N
=> Liên kết cộng hóa trị, mỗi N góp 3 electron tạo thành 3 cặp electron dùng chung
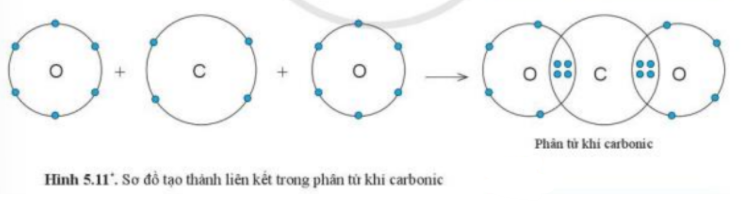
b) Xét phân tử Carbon dioxide: gồm 1 nguyên tử C và 2 nguyên tử O
=> Liên kết cộng hóa trị. Khi C kết hợp với O, nguyên tử C góp 4 electron, mỗi nguyên tử O góp 2 electron
=> Giữa nguyên tử C và nguyên tử O có 2 cặp electron dùng chung
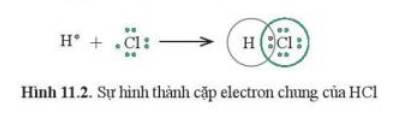


Nguyên tử Cl có 7 electron lớp ngoài cùng và cần thêm 1 electron để có lớp vỏ bền vững tương tự khí hiếm.
Từ đây em tự vẽ khi mỗi nguyên tử góp 1e dùng chung