
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Bài 1:
Số mol sắt tham gia phản ứng:
nFe = 0,05 mol
a) Thể tích khí hiđro thu được ở đktc:
Fe + 2HCl → FeCl2 + H2.
Theo phương trình hóa học, ta có: nH2 = nFe = 0,05 mol
Thể tích khí thu được ở đktc là: VH2= 22,4 . n = 22,4 . 0,05 = 1,12 lít
b) Khối lượng axit clohiđric cần dùng
Theo phương trình hóa học, ta có:
nHCl = 2nFe = 2 . 0,05 = 0,1 mol
Khối lượng HCl cần dùng là: mHCl = M . n = 0,1 . 36,5 = 3,65 g
Bài 2:
a) Phương trình hóa học của S cháy trong không khí:
S + O2 → SO2
Số mol của S tham gia phản ứng:
nS = 16/32 = 0,05 mol
Theo phương trình hóa học, ta có: nSO2 = nS = nO2 = 0,05 mol
=> Thể tích khí sunfurơ sinh ra ở đktc là:
VSO2= 22,4 . 0,05 = 1,12 lít
Tương tự thể tích khí oxi cần dùng ở đktc là:
VO2 = 22,4 . 0,05 = 1,12 lít
Vì khí oxi chiếm 1/5 thể tích của không khí nên thể tích không khí cần là:
=> Vkk = 5 VO2 = 5 . 1,12 = 5,6 lít
Bài 1 :
a) PTPU
Theo pt: nH2 = nFe = 0,05 (mol)
VH2 = 22,4.n = 22,4.0,05 = 1,12 (lít)
b) nHCl = 2.nFe = 2. 0,05 = 0,1 (mol)
mHCl = M.n = 0,1.36,5 = 3,65 (g)
Bài 2 :
a) Phương trình hóa học của S cháy trong không khí:
S + O2 to→→to SO2
b) Số mol của S tham gia phản ứng:
nS = 1,6321,632 = 0,05 mol
- Theo phương trình hóa học, ta có: nSO2nSO2 = nS = 0,05 mol
Thể tích khí sunfurơ sinh ra ở đktc là:
VSO2VSO2 = 22,4 . 0,05 = 1,12 (lít)
- Theo phương trình hóa học, ta có: nO2nO2 = nS = 0,05 mol
Thể tích khí oxi cần dùng ở đktc là:
VO2VO2 = 22,4 . 0,05 = 1,12 (lít)
Vì khí oxi chiếm 1/5 thể tích của không khí nên thể tích không khí cần dùng ở đktc là:
Vkk = 5VO2VO2 = 5 . 1,12 = 5,6 (lít)

1)a) Phản ứng hóa học là quá trình làm biến đổi chất này (chất tham gia phản ứng) thành chất khác (sản phẩm hay chất tạo thành).
b) Chất ban đầu bị biến đổi trong phản ứng gọi là chất tham gia. Chất mới sinh ra là sản phẩm hay chất tạo thành.
c) Trong quá trình phản ứng, lượng chất tham gia giảm dần, lượng sản phẩm tăng dần.
2)
a) Khi chất có phản ứng chính là phân tử phản ứng (nếu là đơn chất kim loại thì nguyên tử phản ứng) vì hạt hợp thành của hầu hết các chất là phân tử, mà phân tử thể hiện đầy đủ tính chất hóa học của chất. đơn chất kim loại có hạt hợp thành là nguyên tử, nên nguyên tử tham gia phản ứng .
b) Trong phản ứng hóa học chỉ xảy ra sự thay đổi liên kết giữa các nguyên tử. kết quả là chất này biến đổi thành chất khác.
c) Theo hình 2.5 (trang 48 sgk), ta có thể nói rằng số lượng nguyên tử mỗi nguyên tố có giữ nguyên trước và sau phản ứng.
3)
Phản ứng hóa học:
Parafin + O -> CO2 + hơi nước
Chất tham gia phản ứng : parafin, O .
Sản phẩm: \(CO_2\), hơi nước.
4) “ Trước khi cháy chất paraffin ở thể rắn còn khi cháy ở thể hơi. Các phân tử parafin phản ứng với các phân tử khí oxi”
5)
Phương trình phản ứng:
Axit clohidric + canxi cacbonat -> canxi clorua + cacbon dioxit + nước
Chất phản ứng: HCl và CaCO3.
Sản phẩm: CaCl2, CO2, H2O
6)
a) Cần đập vừa nhỏ than trước khi đưa vào lò đốt để tăng bề mặt tiếp xúc của than với khí oxi (trong không khí). Dùng que lửa châm để làm tăng nhiệt độ của than, quạt mạnh để thêm đủ oxi. Khi than bén cháy thì đã có phản ứng hóa học xảy ra.
b) Phương trình chữ phản ứng:
Than + Oxi (qua nhiệt độ ) \(\xrightarrow[]{}\)\(CO_3\) + nhiệt lượng


Câu 6:a)\(Fe+2HCl\rightarrow FeCl_2+H_2\)
b)\(n_{H_2}:\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
1...............2...........................1(mol)
0,25...........0,5,,,,,,,,,,,,,,,,,,,,,,0,25(mol)
\(m_{Fe}:56.0,25=14\left(g\right)\)
c)\(m_{HCl}:36,5.0,5=18,25\)
d)\(n_{CuO}:\dfrac{8}{80}=0,1\left(mol\right)\)
\(H_2+CuO\rightarrow Cu+H_2O\)
1.............1...........1..............(mol)
0,1........0,1..........0,1............(mol)
=>Hidro dư
\(m_{Cu}:0,1.64=6,4\left(g\right)\)
Câu 5:
a)\(Mg+2HCl\rightarrow MgCl_2+H_2\)
b)\(n_{Mg}:\dfrac{3,6}{24}=0,15\left(mol\right)\)
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
1..............2...............1.............1(mol)
0,15..........0,3............0,15.......0,15(mol)
\(m_{MgCl_2}:0,15.95=14,25\left(g\right)\)
\(V_{H_2}:0,15.22,4=3,36\left(l\right)\)
c)\(m_{HCl}:0,3.36,5=10,95\left(g\right)\)
d)\(n_{CuO}:\dfrac{16}{80}=0,2\left(mol\right)\)
\(H_2+CuO\rightarrow Cu+H_2O\)
1.............1..........1..............(mol)
0,15........0,15......0,15.........(mol)
\(m_{Cu}:0,15.65=9,75\left(g\right)\)
\(m_{CuO}dư:\left(0,2-0,15\right).80=4\left(g\right)\)


1. Gọi số mol Fe trong hỗn hợp là a
m = mNa + mFe
+) Hỗn hợp tác dụng hết với HCl:
2Na + 2HCl → 2NaCl + H2↑
Fe + 2HCl → FeCl2 + H2↑
a----------------->a
Dung dịch thu được gồm: NaCl, FeCl2, HCl (có thể còn dư)
+) Dung dịch thu được tác dụng với Ba(OH)2 dư:
2HCl + Ba(OH)2 → BaCl2 + 2H2O
FeCl2 + Ba(OH)2 → BaCl2 + Fe(OH)2↓
a--------------------------------------->a
Kết tủa: Fe(OH)2
+) Nung kết tủa đến khối lượng không đổi:
4Fe(OH)2 + O2 → 2Fe2O3 + 4H2O
a---------------------------a/2
mcr = m = mFe2O3 = a/2 . 160 = 80a
\(m_{Fe}=\dfrac{56a}{80a}.100=70\%\)
%mNa=100%−70%=30%
2/
CaCO3 ---to--> CaO + CO2
x----------------------x
MgCO3 ---to--> MgO + CO2
y----------------------y
mban đầu= 2.msau nung
=> 100x+84y = 2 .(56x+40y)
=> 12x = 4y
=> \(\dfrac{n_{CaCO_3}}{n_{MgCO_3}}=\dfrac{1}{3}\)
Đặt n CaCO3 = 1mol => n MgCO3 = 3mol
%CaCO3=\(\dfrac{100}{100+84.3}.100\)=28,41%
%MgCO3=100-28,41=71,59%

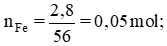
 Mb đang onl giúp mik vs nha! Cần gấp Y_Y !!!
Mb đang onl giúp mik vs nha! Cần gấp Y_Y !!!


1.
a. PTHH biểu diễn đơn giản PỨHH
gồm CTHH của chất phản ứng và chất sản phẩm
b. Sơ đồ phản ứng khác với PTHH ở điểm:
PTHH đã cân = số nguyên tử mỗi nguyên ti61, còn sơ đồ phản ứng chưa cân bằng số nguyên tử mỗi nguyên tố
c. Ý nghĩa củ PTHH: PTHH cho biết tỉ lệ về số nguyên tử, số phân tử giữa các chất cũng nư chưa từng cặp chất trong phản ứng.
2.
a. 4Na+O2->2Na2O. Tỉ lệ số nguyên tử, phân tử: 4:1:2
b. P2O5+2H2O->2H3PO4. Tỉ lệ số nguyên tử, phân tử: 1:3:2
3.
a. 2HgO->2Hg+O2. Tỉ lệ số phân tử, nguyên tử: 2:1:2:1
b. 2Fe(OH)3->Fe2O3+3H2O. Tỉ lệ số phân tử, nguyên tử: 2:1:3
4.
a. Na2CO3+NaCl2->CaCO3+2NaCl
5.
a. Mg+H2SO4->H2+MgSO4
6.
a. 4P+5O2-> 2P2O5
b. Tỉ lệ : 2:5
7.
a. 2Cu+O2->2CuO
b. Zn +2HCl->ZnXl2+H2
c. CaO+2HNO3->Ca(NO3)2+H2O
Bài 1
a) Phương trình hóa học là phương trình biểu diễn ngắn gọn phản ứng hóa học, gồm công thức hóa học của chất tham gia phản ứng và sản phẩm.
b) Sơ đồ phản ứng khác với phương trình hóa học là chưa có hệ số thích hợp, tức là chưa cân bằng số nguyên tử. tuy nhiên cũng có một số sơ đồ phản ứng cũng chính là phương trình hóa học
Ví dụ: Mg + Cl2 => MgCl2
c) Ý nghĩa: phương trình hóa học cho biết tỉ lệ số nguyên tử, số phân tử giữa các chất cũng như từng cặp chất trong phản ứng.
Bài 2
a) Phương trình hóa học: 4Na + O2 => 2Na2O.
Tỉ lệ: Số nguyên tử Na: số phân tử O2: số phân tử Na2O = 4 : 1 : 2.
b) Phương trình hóa học: P2O5 + 3H2O => 2H3PO4.
Tỉ lệ: Số phân tử P2O5 : số phân tử H2O : số phân tử H3PO4 = 1 : 3 : 2.
Bài 3
a) Phương trình hóa học: 2HgO ->2 Hg + O2
Tỉ lệ: Số phân tử HgO : số nguyên tử Hg : số phân tử O2 = 2 : 2 : 1
b) Phương trình hóa học: 2Fe(OH)3 - > Fe2O3 + 3H2O
Tỉ lệ: Số phân tử Fe(OH)3 : số phân tử Fe2O3 : số phân tử H2O = 2 : 1 : 3
Bài 4
a) Phương trình hóa học:Na2CO3+CaCl2→CaCO3+2NaCl
b) Ta có: 11 phân tử natri cacbonat và 11 phân tử canxi clorua tạo ra 11 phân tử canxi cacbonat và 22 phân tử natri clorua.
Tỉ lệ: Natri cacbonat : canxi clorua là 1:11:1
Canxi cacbonat : natri clorua là 1:21:2
Canxi clorua : natri clorua là 1:21:2
Natri cacbonat : canxi cacbonat là 1:11:1
Bài 5
a) Phương trình hóa học phản ứng:
Mg + H2SO4 -> H2 + MgSO4
b) Phân tử magie : phân tử axit sunfuric = 1 : 1
Phân tử magie : phân tử hidro = 1 : 1
Phân tử magie : phân tử magie sunfat = 1 : 1
Bài 6
a) Phương trình hóa học của phản ứng :
4P + 5O2 -> 2 P2O5
b) Tỉ lệ
Số phân tử P : số phân tử O2 : số phân tử P2O5 = 4 : 5 : 2
Bài 7
a) 2Cu+O2→2CuO
b) Zn+2HCl→ZnCl2+H2
c) CaO+2HNO3→Ca(NO3)2+H2O