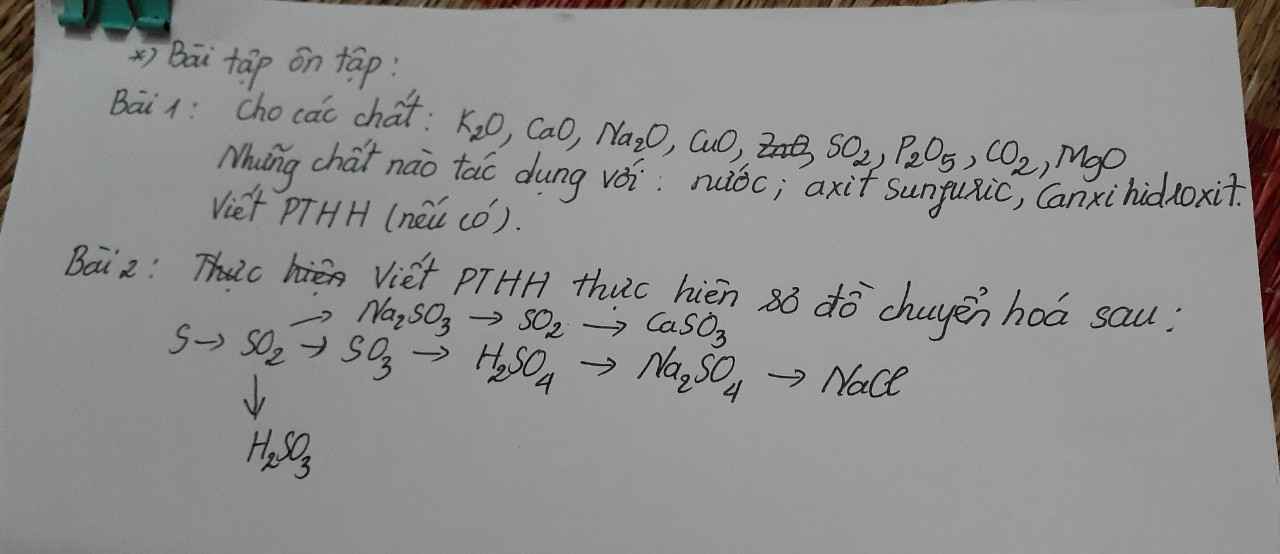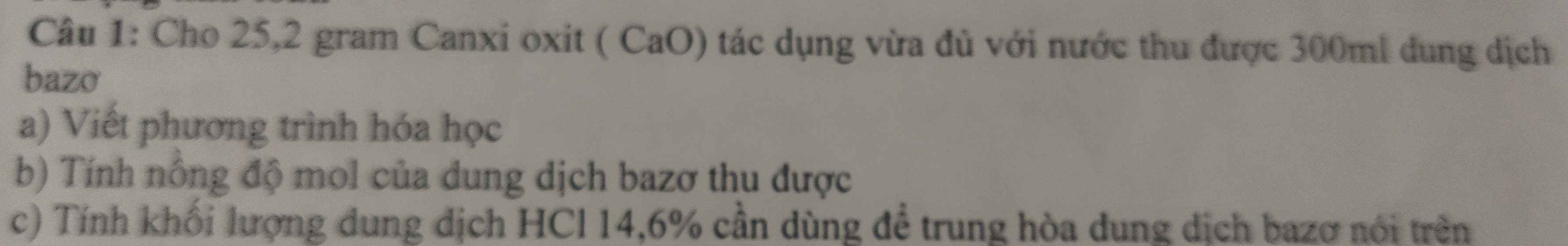Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Bài 1:
\(K_2O+H_2O\rightarrow2KOH\)
\(CaO+H_2O\rightarrow Ca\left(OH\right)_2\)
\(Na_2O+H_2O\rightarrow2NaOH\)
\(SO_2+H_2O⇌H_2SO_3\)
\(P_2O_5+3H_2O\rightarrow2H_3PO_4\)
\(CO_2+H_2O⇌H_2CO_3\)
\(K_2O+H_2SO_4\rightarrow K_2SO_4+H_2O\)
\(CaO+H_2SO_4\rightarrow CaSO_4+H_2O\)
\(Na_2O+H_2SO_4\rightarrow Na_2SO_4+H_2O\)
\(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
\(ZnO+H_2SO_4\rightarrow ZnSO_4+H_2O\)
\(MgO+H_2SO_4\rightarrow MgSO_4+H_2O\)
\(ZnO+Ca\left(OH\right)_2\rightarrow CaZnO_2+H_2O\)
\(SO_2+Ca\left(OH\right)_2\rightarrow CaSO_3+H_2O\)
\(P_2O_5+3Ca\left(OH\right)_2\rightarrow Ca_3\left(PO_4\right)_2+3H_2O\)
\(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3+H_2O\)

Các khí tm đề bài là H2,O2,CO2 SO2 do H2SO4đ có khả năng tác dụng với NH3 và CO
H2SO4 +2NH3 =>(NH4)2SO4
HayH2SO4 +CO =>SO2 + CO2 + H2O
* Điều kiện làm khô khí: hóa chất được sử dụng để làm khô khí ko tác dụng với khí được làm khô.
* Sau đây là một số kiến thức về các chất làm khô:
- H2SO4 đặc:
+ Làm khô được: Cl2, NO2, CO2, SO2, O3
+ Không làm khô được: NH3, CO, H2S, NO
- P2O5:
+ Làm khô được: CO2, SO2, H2S, Cl2, NO2, NO, CO, O3
+ Không làm khô được: NH3
- CaO:
+ Làm khô được: NH3, CO, O3, NO
+ Không làm khô được: CO2, SO2, NO2, H2S, Cl2
- NaOH rắn (khan):
+ Làm khô được: NH3, CO, O3, NO
+ Không làm khô được: CO2, SO2, NO2, H2S, Cl2
- CaCl2 khan:
+ Làm khô được: NH3, CO2, SO2, NO2, H2S, Cl2, NO, CO, O3.
* Quay lại bài toán:
Do H2SO4 đặc có tính oxi hóa mạnh nên sẽ tác dụng với những khí có tính khử mạnh NH3 và CO
Vậy những khí được làm khô gồm: H2, CO2, SO2, O2.


1/ \(n_S=\dfrac{6,4}{32}=0,2;n_{H_2SO_4}=\dfrac{14.70\%}{98}=0,1\)
Bảo toàn nguyên tố S : \(n_S=n_{H_2SO_4\left(lt\right)}=0,2\)
Mà thực tế chỉ thu được 0,1
=> \(H=\dfrac{0,1}{0,2}.100=50\%\)
2/ \(n_{N_2}=0,2\left(mol\right);n_{H_2}=0,3\left(mol\right);n_{NH_3}=0,15\left(mol\right)\)
PTHH: \(N_2+3H_2\rightarrow2NH_3\)
Lập tỉ lệ : \(\dfrac{0,2}{1}>\dfrac{0,3}{3}\)=> Sau phản ứng N2 dư, tính theo số mol H2
=> n NH3(lt)= \(\dfrac{0,3.2}{3}=0,2\left(mol\right)\)
Mà thực tế chỉ thu được 0,15 mol
=> \(H=\dfrac{0,15}{0,2}.100=75\%\)

Bài 5:
CTPT: CxHyO
\(n_{CaCO_3}=\dfrac{40}{100}=0,4\left(mol\right)\)
PTHH: 2CxHyO + \(\dfrac{4x+y-2}{2}\)O2 --to--> 2xCO2 + yH2O
\(\dfrac{0,4}{x}\)<--\(\dfrac{0,4\left(4x+y-2\right)}{4x}\)<------0,4
Ca(OH)2 + CO2 --> CaCO3 + H2O
0,4<-----0,4
=> \(M_{C_xH_yO}=\dfrac{7,4}{\dfrac{0,4}{x}}=18,5x\left(g/mol\right)\)
=> y + 16 = 6,5x (1)
Có \(n_{O_2}=\dfrac{19,2}{32}=0,6\left(mol\right)\)
=> \(\dfrac{0,4\left(4x+y-2\right)}{4x}=0,6\)
=> 0,8x = 0,4y - 0,8 (2)
(1)(2) => x = 4; y = 10
CTPT: C4H10O

a) nCuCl2 = 0,15.2 = 0,3 (mol)
PTHH: 2Al + 3CuCl2 --> 2AlCl3 + 3Cu
____0,2<------0,3--------->0,2---->0,3
=> m = 0,3.64 - 0,2.27 = 13,8 (g)
b) \(C_{M\left(AlCl_3\right)}=\dfrac{0,2}{0,15}=1,3333M\)


 4,5 với ạ
4,5 với ạ