
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


1.
(1) CuSO4 + Fe ➜FeSO4+Cu
(2) 2NaOH +FeSO4 ➜Na2SO4+Fe(OH)2
(3)Fe(OH)2 +2HCl ➞ FeCl2 +2H2O
(4)FeCl2➞ Fe +Cl2
(5) 2Fe + 6H2SO4➞Fe2(SO4)3 +3SO2 +6H2O
(6) 3Fe2(SO4)3 + BaCl2➞2FeCl3 +3BaSO4
2.
a) 2Al +3CuSO4➞Al2(SO4)3 +3Cu
- Hiện tượng xảy ra :Có chất rắn màu nâu đỏ chính là đồng bám bên ngoài lá nhôm ,màu xanh của dd CuSO4 nhạt dần
b)Zn + CuCl2 ➞ ZnCl2 +Cu
- Đồng clorua đang ở màu xanh lam ➝nhạt màu ➝xuất hiện chất rắn (kết tủa màu đỏ bám vào thanh kẽm)
c)2Na + 2H2O ➞ 2NaOH +H2
2NaOH +CuSO4 ➞Cu(OH)2+Na2SO4
- có khí không màu thoát ra ,thu đc kết tủa xanh đậm.

Bài 2:
_ Trích mẫu thử.
_ Nhỏ một lượng từng mẫu thử vào ống nghiệm đựng dd BaCl2.
+ Nếu có kết tủa, đó là MgSO4 và Na2SO4. (1)
PT: \(BaCl_2+MgSO_4\rightarrow MgCl_2+BaSO_{4\downarrow}\)
\(BaCl_2+Na_2SO_4\rightarrow2NaCl+BaSO_{4\downarrow}\)
+ Nếu không hiện tượng, đó là MgCl2 và NaNO3 (2)
_ Nhỏ một lượng mẫu thử nhóm (1) vào ống nghiệm đựng dd NaOH vừa đủ.
+ Nếu xuất hiện kết tủa, đó là MgSO4
PT: \(MgSO_4+2NaOH\rightarrow Na_2SO_4+Mg\left(OH\right)_{2\downarrow}\)
+ Nếu không hiện tượng, đó là Na2SO4.
_ Nhỏ một lượng mẫu thử nhóm (2) vào ống nghiệm đựng dd AgNO3.
+ Nếu có kết tủa trắng, đó là MgCl2.
PT: \(MgCl_2+2AgNO_3\rightarrow Mg\left(NO_3\right)_2+AgCl_{\downarrow}\)
+ Nếu không hiện tượng, đó là NaNO3.
_ Dán nhãn.
Bạn tham khảo nhé!
Bài 1:
(1) \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
(2) \(ZnCl_2+2NaOH\rightarrow2NaCl+Zn\left(OH\right)_2\)
(3) \(Zn\left(OH\right)_2\underrightarrow{t^o}ZnO+H_2O\)
(4) \(ZnO+H_2SO_4\rightarrow ZnSO_4+H_2O\)
(5) \(ZnSO_4+2KOH\rightarrow K_2SO_4+Zn\left(OH\right)_2\)
Bạn tham khảo nhé!

Tự luận
Câu 1 :
Trích mẫu thử
Cho $Ba(HCO_3)_2$ vào mẫu thử
- mẫu thử tạo khí không màu là $HCl$
$Ba(HCO_3)_2 + 2HCl \to BaCl_2 + 2CO_2 + 2H_2O$
- MT tạo kết tủa trắng là $Na_2SO_4$
$Ba(HCO_3)_2 + Na_2SO_4 \to BaSO_4 + 2NaHCO_3$
- MT tạo khí không màu và kết tủa trắng là $H_2SO_4$
$Ba(HCO_3)_2 + H_2SO_4 \to BaSO_4 + 2CO_2 + 2H_2O$
- MT không hiện tượng là $NaCl$
Câu 2 :
$S + O_2 \xrightarrow{t^o} SO_2$
$2SO_2 + O_2 \xrightarrow{t^o} 2SO_3$
$SO_3 + H_2O \to H_2SO_4$
$NaCl + H_2SO_{4_{đặc}} \xrightarrow{t^o} NaHSO_4 + HCl$
Câu 3 :
a) $2Al + 6HCl \to 2AlCl_3 + 3H_2$
$n_{HCl} = 0,1.3 = 0,3(mol)$
$n_{Al} = \dfrac{1}{3}n_{HCl} = 0,1(mol)$
$n_{H_2} = \dfrac{1}{2}n_{HCl} = 0,15(mol)$
Suy ra:
$m = 0,1.27 = 2,7(gam)$
$V = 0,15.22,4 = 3,36(lít)$


2.
\(X:CaCO_3,Y:CO_2,Z:Na_2CO_3,T:BaCO_3\\ Ca\left(HCO_3\right)_2+Ca\left(OH\right)_2->2CaCO_3+2H_2O\\ Ca\left(HCO_3\right)_2-t^0->CaCO_3+CO_2+H_2O\\ Ca\left(HCO_3\right)_2+2NaOH->CaCO_3+Na_2CO_3+2H_2O\\ Ca\left(HCO_3\right)_2+Ba\left(OH\right)_2->CaCO_3+BaCO_3+H_2O\)
\(3.\\ A:Fe_3O_4,B:FeCl_3,C:FeCl_2,D:Fe_2\left(SO_4\right)_3,E:Fe\left(OH\right)_3,F:Fe_2O_3\\ 3Fe+2O_2-t^0->Fe_3O_4\\ Fe_3O_4+8HCl->FeCl_2+2FeCl_3+4H_2O\\ 2FeCl_3+Fe->3FeCl_2\\ FeCl_2+Mg->MgCl_2+Fe\\ 2Fe+6H_2SO_{4\left(đ\right)}-t^0->Fe_2\left(SO_4\right)_3+3SO_2+6H_2O\\ Fe_2\left(SO_4\right)_3+6NaOH->2Fe\left(OH\right)_3+3Na_2SO_4\\ 2Fe\left(OH\right)_3-t^0->Fe_2O_3+3H_2O\\ Fe_2O_3+3H_2SO_4->Fe_2\left(SO_4\right)_3+3H_2O\)

1/ \(n_S=\dfrac{6,4}{32}=0,2;n_{H_2SO_4}=\dfrac{14.70\%}{98}=0,1\)
Bảo toàn nguyên tố S : \(n_S=n_{H_2SO_4\left(lt\right)}=0,2\)
Mà thực tế chỉ thu được 0,1
=> \(H=\dfrac{0,1}{0,2}.100=50\%\)
2/ \(n_{N_2}=0,2\left(mol\right);n_{H_2}=0,3\left(mol\right);n_{NH_3}=0,15\left(mol\right)\)
PTHH: \(N_2+3H_2\rightarrow2NH_3\)
Lập tỉ lệ : \(\dfrac{0,2}{1}>\dfrac{0,3}{3}\)=> Sau phản ứng N2 dư, tính theo số mol H2
=> n NH3(lt)= \(\dfrac{0,3.2}{3}=0,2\left(mol\right)\)
Mà thực tế chỉ thu được 0,15 mol
=> \(H=\dfrac{0,15}{0,2}.100=75\%\)


43.a) \(m_{HCl\left(bđ\right)}=200.10,95\%=21,9\left(g\right)\)
=> \(n_{HCl\left(bđ\right)}=\dfrac{21,9}{36,5}=0,6\left(mol\right)\)
b) HCl phản ứng với NaOH là HCl dư
\(HCl+NaOH\rightarrow NaCl+H_2O\)
\(n_{HCl\left(dư\right)}=n_{NaOH}=0,05.2=0,1\left(mol\right)\)
=> \(n_{HCl\left(pứ\right)}=n_{HCl\left(bđ\right)}-n_{HCl\left(dư\right)}=0,6-0,1=0,5\left(mol\right)\)
c) \(CaCO_3+2HCl\rightarrow CaCl_2+H_2O+CO_2\)
\(n_{CaCO_3}=\dfrac{1}{2}n_{HCl\left(pứ\right)}=0,25\left(mol\right)\)
=> \(m_{CaCO_3}=0,25.100=25\left(g\right)\)
d) \(n_{CO_2}=\dfrac{1}{2}n_{HCl\left(pứ\right)}=0,25\left(mol\right)\)
=> \(V_{CO_2}=0,25.22,4=5,6\left(l\right)\)
e) \(m_{ddsaupu}=25+200-0,25.44=214\left(g\right)\)
Dung dịch A gồm CaCl2 và HCl dư
\(n_{CaCl_2}=\dfrac{1}{2}n_{HCl\left(pứ\right)}=0,25\left(mol\right)\)
\(C\%_{CaCl_2}=\dfrac{0,25.111}{214}.100=12,97\%\)
\(C\%_{HCl\left(dư\right)}=\dfrac{0,1.36,5}{214}.100=1,71\%\)

43. FeO+H2->Fe+H2O![]()
44. CUO+H2->CU+H2O
45. FE2O3+3CO->2FE+3CO2
46. FE3O4+4CO->3FE+4CO2
47. FEO+CO->FE+CO2
48. CUO+CO->CU+CO2
BÀI 2. HCL NACL HNO3
TRÍCH MẪU THỬ VÀO ỐNG NGHIỆM ĐÃ ĐÁNH SỐ
CHO QUỲ TÍM VÀO CÁC MẪU THỬ
MẪU THỬ LÀM QUỲ TÍM HÓA ĐỎ LÀ HCL HNO3
MT KO LÀM QUỲ TÍM ĐỔI MÀU LÀ NACL
CHO AGNO3 VÀO 2 MẪU THỬ LÀM QT HÓA ĐỎ
MT XUẤT HIỆN KẾT TỬ TRẮNG LÀ HCL
MT KO CÓ HT LÀ HNO3
AGNO3+HCL->AGCLkết tủa+HNO3
DÁN NHÃN CHO CÁC MẪU THỬ
 Giải dùm em bài 1,2,3,4,5 với ạ
Giải dùm em bài 1,2,3,4,5 với ạ giải dùm em với ạ
giải dùm em với ạ Giải dùm em ạ
Giải dùm em ạ
 giải dùm em voi
giải dùm em voi
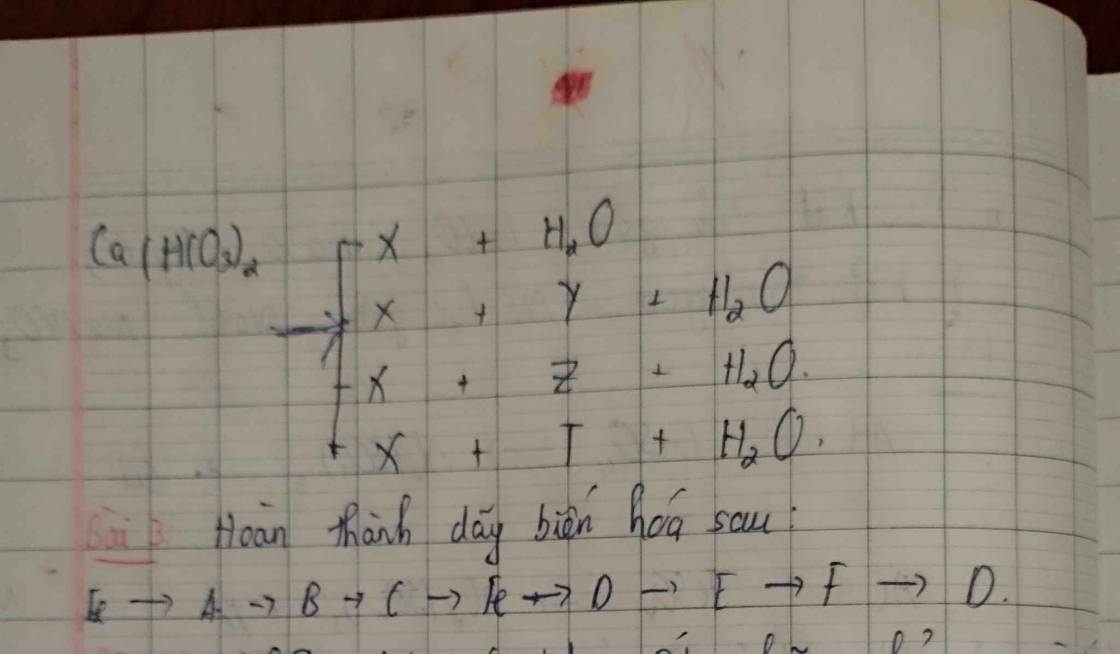




Bài 1:
a, \(Mg\left(OH\right)_2\underrightarrow{t^o}MgO+H_2O\)
b, \(Fe_2O_3+6HNO_3\rightarrow2Fe\left(NO_3\right)_3+3H_2O\)
c, \(BaCO_3+2HCl\rightarrow BaCl_2+H_2O+CO_2\)
d, \(CO_2+KOH\rightarrow KHCO_3\)
Bài 2:
_ Trích mẫu thử.
_ Cho lần lượt từng mẫu thử tác dụng với dd H2SO4.
+ Nếu có khí thoát ra, đó là K2CO3.
PT: \(K_2CO_3+H_2SO_4\rightarrow K_2SO_4+H_2O+CO_2\)
+ Nếu xuất hiện kết tủa trắng và có khí thoát ra, đó là BaCO3.
PT: \(BaCO_3+H_2SO_4\rightarrow BaSO_{4\downarrow}+H_2O+CO_2\)
+ Nếu không có hiện tượng, đó là BaSO4.
_ Dán nhãn.
Bạn tham khảo nhé!
Bài 3 :
$n_{HCl} = 0,4.2 =0,8(mol)$
$Mg(OH)_2 + 2HCl \to MgCl_2 + 2H_2O$
$Ba(OH)_2 + 2HCl \to BaCl_2 + 2H_2O$
$NaOH + HCl \to NaCl + H_2O$
Theo PTHH :
n H2O = n HCl = 0,8(mol)
Bảo toàn khối lượng :
m + m HCl = m muối + m H2O
=> m = 48,2 + 0,8.18 - 0,8.36,5 = 33,4(gam)