Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Khi cho NaOH, hay Ca(OH)2 dư tác dụng 1/2 dd X, đều xảy ra phản ứng:
HCO3- + OH- → CO32- + H2O.(1)
Ca2+ + CO32- → CaCO3.(2)
Khi tác dụng Ca(OH)2 dư thì do Ca2+ và OH- dư nên n(↓ phần 2) = n(HCO3-) = 4,5/100= 0,045 mol.
Khi tác dụng NaOH dư, do OH- dư nên HCO3- phản ứng hết. với n(HCO3-) = 0,045. Trong khi n(↓ phần 1) = 2/100 = 0,02 < 0,045
⇒ kết tủa tính theo Ca2+ với n(Ca2+) = n(↓ phần 1) = 0,02 mol.
Bảo toàn điện tích ( trong 1/2 dd) → n(Na+) + 2n(Ca2+)=n(HCO3-) + n(Cl-)
=> n(Na+) = 0,045 + 0,035- 0,02.2= 0,04 mol
Khi đun sôi thu được muối chứa Na+( tính trong 1/2 dd): 2HCO3- → CO32- + CO2+ H2O
0,04 mol Na+; 0,02 mol Ca2+; 0,035 mol Cl-; 0,045/2 CO32-.
Khi nung nóng:
Ca2+ + CO32- → CaCO3
Ban đầu 0,02 0,0225
Sau phản ứng - 0,0025 0,02
CaCO3 → CaO + CO2
0,02 → 0,02
Chất rắn gồm: 0,04 mol Na+; 0,0025 mol CO32-; 0,035 mol Cl- và 002 mol CaO
→ m =2.( 0,04.23 + 0,0025.60 + 0,035.35,5 + 0,02.56) = 6,865 gam.

Đáp án C.
1/2 X tác dụng với dung dịch NaOH thu được ít kết tủa hơn khi tác dụng với dung dịch Ba(OH)2, nên khi tác dụng với NaOH thì Ba2+ hết.
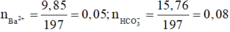
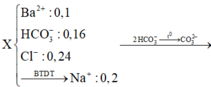
![]()
![]()

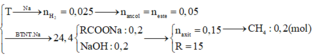
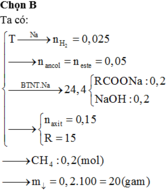
Trong 100ml dung dịch X có 0,1 mol Ba2+, 0,15 mol HCO3-
Trong 200ml dung dịch X có 0,2 mol Cl-
Do đó trong 50ml dung dịch X có 0,05 mol Ba2+, 0,075 mol HCO3- , 0,05 mol Cl- và x mol K+.
Theo định luật bảo toàn điện tích được x = 0,025.
Khi cô cạn xảy ra quá trình: 2HCO3- ⟶ CO32- + CO2 + H2O
Do đó: n C O 3 2 - = 0 , 0375
Vậy khối lượng chất rắn khan thu được là: m K + + m B a 2 + + m C O 3 2 - + m C l - = 11 , 85 ( g a m )
Đáp án C

Theo BTĐT: x = (0,12 + 0,05 – 0,12) : 2 = 0,025 mol.
Cho 0,03 mol Ba(OH)2 phản ứng với ddX
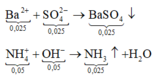
Vậy khi phản ứng xảy ra hoàn toàn, lọc bỏ kết tủa thu được ddY gồm 0,12 mol Na+; 0,12 mol Cl−; 0,005 mol Ba2+; 0,01 mol OH−
Vậy m = 0,12x23 + 0,12x35,5 + 0,005x137 + 0,01x17 = 7,875 gam
Đáp án A

Đáp án C
Dung dịch X + AgNO3 dư ⇒ mAgCl = 17,22 gam ⇒ nCl– = 0,12 mol.
+ Bảo toàn điện tích ⇒ nCu2+ = 0,01 mol.
+ Cho dung dịch X + 0,17 mol NaOH.
Tạo 0,04 mol Mg(OH)2 và 0,01 mol Cu(OH)2 tốn 0,1 mol NaOH.
+ Còn 0,07 mol NaOH tác dụng với Al3+.
⇒ nAl(OH)3↓ = 4nAl3+ – OH– = 0,02×4 – 0,07 = 0,01 mol.
⇒ m↓ = 0,04×58 + 0,01×98 + 0,01×78 = 4,08 gam

Đáp án A
Trong 300 ml dung dịch X có m gam Al 2 SO 4 3 , suy ra trong 150 ml dung dịch X sẽ có 0,5m gam Al 2 SO 4 3 và có số mol là x.
Lượng Al 2 SO 4 3 phản ứng ở 2 thí nghiệm là như nhau. Lượng OH - ở TN2 nhiều hơn ở TN1, lượng kết tủa (y mol) ở TN2 ít hơn ở TN1 (2y mol). Chứng tỏ ở TN2 kết tủa Al OH 3 đã bị hòa tan một phần, ở TN1 kết tủa có thể bị hòa tan hoặc chưa bị hòa tan.
● Nếu ở TN1 kết tủa Al OH 3 chưa bị hòa tan, áp dụng bảo toàn điện tích trong các dung dịch sau phản ứng, ta có :
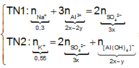
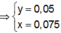
![]() thỏa mãn
thỏa mãn
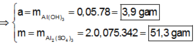
● Ở TN1 kết tủa Al OH 3 đã bị hòa tan, áp dụng bảo toàn điện tích cho dung dịch sau phản ứng, ta có:
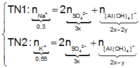
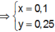
![]() (loại) (*)
(loại) (*)
PS : Nếu không sử dụng biểu thức (*) để biện luận loại trường hợp không thỏa mãn thì sẽ tính ra đáp án B. Nhưng đó là kết quả sai.

Đáp án C
nAgCl=0.12 (mol)
BTĐT:

Na+:0.17(mol)
Kết tủa gồm: Al(OH)3:0.01(mol),Cu(OH)2:0.01(mol),
Mg(OH)2:0.04(mol)=> m = 4.08 (g)
Đáp án A