Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

4P + 5O2 ----> 2P2O5
0,24 -> 0,3 ---> 0,12 (mol)
nP = \(\dfrac{7,44}{31}\)= 0,24 (mol)
VH2 = 0,3 . 22,4 = 6,72 (l)
2KClO3 ---> 2KCl + 3O2
0,2 <------------- 0,3 (mol)
mKClO3 = 0,2 . (39 + 35,5 + 16.3)
= 24,5 (g)
Vui lòng kiểm tra lại kết quả dùm, thank you.
nP = 7,44 : 31 = 0,24 ( mol)
pthh : 4P + 5O2 -t--> 2P2O5
0,24->0,3 (mol)
=> VO2 =0,3 . 22,4 = 6,72 (l)
pthh : 2KClO3 -t--> 2KCl + 3O2
0,2<-------------------0,3 (mol)
=> mKClO3 = 0,2 .122,5 = 24,5 (g)

a) Do khí oxi thu được hao hụt 10% nên hiệu suất phản ứng là 90%.
Thể tích khí oxi thu được là:
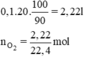
Phương trình hóa học của phản ứng nhiệt phân KMnO4:
2KMnO4 -to→ O2 + K2MnO4 + MnO2.
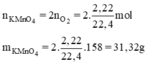
b) Ý b) tách biệt so với ý a), ngoài ra ở ý b) không cho lượng oxi hao hụt là bao nhiêu nên ta lấy hiệu suất phản ứng đạt 100%.
Thể tích khí oxi thu được là: V = 0,1.20 = 2 (lít)


nFe3O4 = 2,32 : 232 = 0,1 (mol)
pthh : 3Fe + 2O2 -t--> Fe3O4 (phản ứng hóa hợp )(có 2 chất sinh ra 1 chất mới)
0,3 <-- 0,2 < ------------0,1(mol)
=> VO2 = 0,2 . 22,4 = 4,48 (l)
%mFe = 168 .100 / 232 = 72,4 %

a, \(2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
b, \(n_{KClO_3}=\dfrac{19,6}{122,5}=0,16\left(mol\right)\)
Theo PT: \(n_{O_2}=\dfrac{3}{2}n_{KClO_3}=0,24\left(mol\right)\Rightarrow V_{O_2}=0,24.22,4=5,376\left(l\right)\)
c, \(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
Theo PT: \(n_{Al}=\dfrac{4}{3}n_{O_2}=0,32\left(mol\right)\Rightarrow m_{Al}=0,32.27=8,64\left(g\right)\)
a) \(2KClO_3\underrightarrow{t^o}2KCl+3O_2\uparrow\)
b) số mol của 19,6 g \(KClO_3\) là:
\(n_{KClO_3}=\dfrac{m}{M}=\dfrac{19,6}{122,5}=0,16\left(mol\right)\)
thể tích của khí Oxi (đktc) là:
\(V_{O_2}=n.22,4=0,24.22,4=5,376\left(l\right)\)
c)\(PTHH:4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
khối lương Al cần dùng để tác dụng hết Oxi:
\(m_{Al}=n.M=0,32.27=8,64\left(g\right)\)

\(n_{Fe_3O_4}=\dfrac{m_{Fe_3O_4}}{M_{Fe_3O_4}}=\dfrac{23,2}{232}=0,1mol\)
\(3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\)
0,3 0,2 0,1 ( mol )
\(m_{Fe}=n_{Fe}.M_{Fe}=0,3.56=16,8g\)
\(V_{O_2}=n_{O_2}.22,4=0,2.22,4=4,48l\)
\(V_{kk}=\dfrac{4,48.100}{20}=22,4l\)
\(2KMnO_4\rightarrow\left(t^o\right)K_2MnO_4+MnO_2+O_2\)
0,4 0,2 ( mol )
\(n_{KMnO_4}=\dfrac{0,4}{85\%}=\dfrac{8}{17}mol\)
\(m_{KMnO_4}=n_{KMnO_4}.M_{KMnO_4}=\dfrac{8}{17}.158=74,3529g\)

Theo gt ta có: $n_{Mg}=0,15(mol)$
a, $2Mg+O_2\rightarrow 2MgO$
Ta có: $n_{O_2}=0,5.n_{Mg}=0,075(mol)\Rightarrow V_{O_2}=1,68(l)$
b, $2KClO_3\rightarrow 2KCl+3O_2$ (đk: nhiệt độ, MnO2)
Ta có: $n_{KClO_3}=\frac{2}{3}.n_{O_2}=0,05(mol)\Rightarrow m_{KClO_3}=6,125(g)$
\(n_{Mg}=\dfrac{3.6}{24}=0.15\left(mol\right)\)
\(2Mg+O_2\underrightarrow{t^0}2MgO\)
\(0.15......0.075......0.15\)
\(V_{O_2}=0.075\cdot22.4=1.68\left(l\right)\)
\(2KClO_3\underrightarrow{t^0}2KCl+3O_2\)
\(0.05.......................0.075\)
\(m_{KClO_3}=0.05\cdot122.5=6.125\left(g\right)\)


a.b.\(n_{Fe}=\dfrac{6,72}{56}=0,12mol\)
\(3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\)
0,12 0,08 ( mol )
\(V_{O_2}=0,08.22,4=1,792l\)
c.\(2KClO_3\rightarrow\left(t^o,MnO_2\right)2KCl+3O_2\)
4/75 0,08 ( mol )
\(m_{KClO_3}=\dfrac{4}{75}.122,5=6,533g\)
nFe = 6,72 : 56 = 0,12 (mol)
pthh : 3Fe + 2O2 -t--> Fe3O4
0,12 --> 0,08 (mol)
=> VO2 = 0,08 . 22,4 = 1,792 (L)
pthh: 2KClO3 -t--> 2KCl + 3O2
0,053<------------------ 0,08 (mol)
=> mKClO3 = 0,053 . 122,5 = 6,53 (G)