Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Khối lượng chất rắn thu được sau phản ứng lớn hơn khối lượng Fe cho vào Þ Ag+ bị điện hân chưa hết
Catot Anot
Ag+ + 1e → Ag H2O - 2e → 2H+ + 0,5O2
x x x x → x


Đáp án B
Khối lượng chất rắn thu được sau phản ứng lớn hơn khối lượng Fe cho vào
=> Ag+ bị điện phân chưa hết
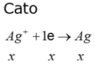
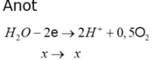
Dung dịch sau điện phân:
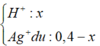
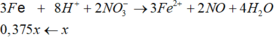
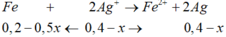
20,4 g chất rắn
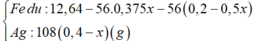
![]()
![]()
![]()
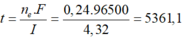

Đáp án B
4AgNO3 + 2H2O → d p d d 4Ag + 4HNO3 + O2
x → x (mol)
Dd X gồm: HNO3: x (mol); AgNO3 dư : 0,3 – x (mol)
Cho Fe vào dd X, sản phẩm thu được có Fe dư ( Vì mAg < 0,3. 108 < 34,28)
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
0,25x ← x → 0,25x
Fe + 2Fe(NO3)3 → 3Fe(NO3)2
0,125x ←0,25x
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag↓
(0,15-0,5x)←(0,3-x)
∆m rắn tăng = mAg sinh ra – mFe pư
=> 34,28 – 22,4 = ( 0,3 – x). 108 – ( 0,25x + 0,125x + 0,15– 0,5x). 56
=> 11, 88 = 24-101x
=> x = 0,12 (mol)
=> nAg+ bị điện phân = 0,12 = It/F
=> t = 0,12. 96500/ 2,68 = 4320 (s) = 1,2 h

Đáp án C
Phản ứng điện phân:
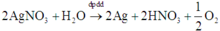
Vì khi cho sắt vào dung dịch Y, kết thúc phản ứng thu được hỗn hợp kim loại nên hỗn hợp này gồm Ag và Fe dư.
Do đó dung dịch thu được chỉ chứa cation Fe2+ và AgNO3 chưa bị điện phân hết.
Gọi n A g N O 3 b ị đ i ệ n p h â n = x thì n A g N O 3 c h ư a b ị đ i ệ n p h â n = 0,15 - x
Dung dịch Y chứa x mol HNO3 và (0,15 - x)mol AgNO3
Áp dụng định luật bảo toàn mol electron, ta có:
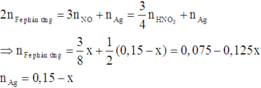
Áp dụng định luật bảo toàn khối lượng ta có:
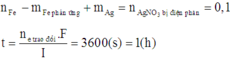

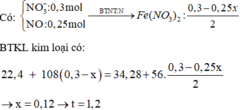
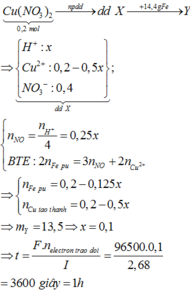

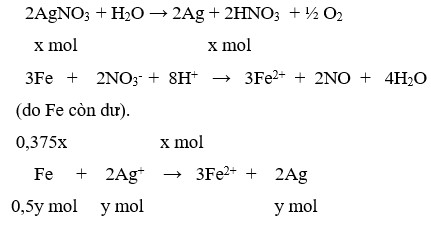
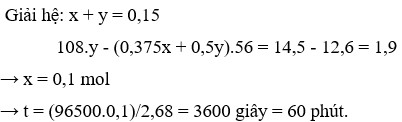




Đáp án D