Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giả sử thanh kim loại ban đầu nặng m (g)
Gọi số mol Cu(NO3)2, Pb(NO3)2 pư là a (mol)
TN1:
PTHH: R + Cu(NO3)2 --> R(NO3)2 + Cu
a<-------a------------------>a
=> mgiảm = a.MR - 64a (g)
Và \(m_{giảm}=\dfrac{0,05m}{100}=0,0005m\left(g\right)\)
=> \(a.M_R-64a=0,0005m\) (1)
TN2:
PTHH: R + Pb(NO3)2 --> R(NO3)2 + Pb
a<-------a------------------->a
=> mtăng = 207a - a.MR (g)
Và \(m_{tăng}=\dfrac{7,1.m}{100}=0,071m\left(g\right)\)
=> \(207a-a.M_R=0,071m\) (2)
(1)(2) => \(\dfrac{M_R-64}{207-M_R}=\dfrac{0,0005}{0,071}\)
=> MR = 65 (g/mol)
=> R là Zn

Gọi số mol Fe phản ứng là a (mol)
PTHH: Fe + CuSO4 --> FeSO4 + Cu
a------------------->a----->a
=> 50 - 56a + 64a = 51
=> a = 0,125 (mol)
=> \(n_{FeSO_4}=0,125\left(mol\right)\)
=> \(m_{FeSO_4}=0,125.152=19\left(g\right)\)
\(Đặt:n_{Fe\left(pứ\right)}=x\left(mol\right)\\ Fe+CuSO_4\rightarrow FeSO_4+Cu\\m_{tăng}=m_{Cu}-m_{Fe\left(pứ\right)}=51-50\\ \Leftrightarrow 64x-56x=1\\ \Rightarrow x=0,125\left(mol\right)\\ n_{FeSO_4}=n_{Fe}=0,125\left(mol\right)\\ \Rightarrow m_{FeSO_4}=0,125.152=19\left(g\right)\)

Gọi \(n_{CuSO_4} = 0,1a(mol)\\\)
\(Fe + CuSO_4 \to FeSO_4 + Cu\)
Theo PTHH :
\(n_{Cu} = n_{Fe\ pư}= 0,1a(mol) \\ \Rightarrow 64.0,1a -56.0,1a = 1,6\\ \Rightarrow a = 2(M)\\ \)

a) 2Al + 6HCl → 2AlCl3 + 3H2
b) nHCl = \(\dfrac{65,7}{36,5}\)= 1,8 mol
Theo tỉ lệ phản ứng => nAl phản ứng = \(\dfrac{nHCl}{3}\)= 0,6 mol
=> mAl phản ứng = 0,6.27 = 16,2 gam
c) nH2 = 1/2nHCl = 0,9 mol
=> V H2 = 0,9.22,4 = 20,16 lít

PTHH: \(Fe+CuSO_4\rightarrow FeSO_4+Cu\)
Đặt \(n_{Fe\left(phản.ứng\right)}=x\left(mol\right)=n_{Cu\left(tạo.ra\right)}\)
\(\Rightarrow64x-56x=0,8\) \(\Rightarrow x=0,1\) \(\Rightarrow\left\{{}\begin{matrix}m_{Fe\left(phản.ứng\right)}=0,1\cdot56=5,6\left(g\right)\\m_{Cu\left(tạo.ra\right)}=0,1\cdot64=6,4\left(g\right)\end{matrix}\right.\)

a) 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
b) nH2 =\(\dfrac{26,88}{22,4}\)=1,2 mol
Theo tỉ lệ phản ứng => nAl phản ứng = \(\dfrac{nH_2.2}{3}\)= 0,8 mol
=> mAl phản ứng = 0,8.27= 21,6 gam
c) nAl2(SO4)3 = 1/2 nAl = 0,4 mol
=> m Al2(SO4)3 = 0,4. 342 = 136,8 gam
a) 2Al+3H2SO4⟶Al2(SO4)3+3H2↑2Al+3H2SO4⟶Al2(SO4)3+3H2↑
b) mAl=21,6gmAl=21,6g
c) mAl2(SO4)3=136,8gmAl2(SO4)3=136,8g
Giải thích các bước giải:
a) Phương trình hoá học:
2Al+3H2SO4⟶Al2(SO4)3+3H2↑2Al+3H2SO4⟶Al2(SO4)3+3H2↑
b) Số mol H2H2 sinh ra sau phản ứng:
nH2=VH222,4=26,8822,4=1,2molnH2=VH222,4=26,8822,4=1,2mol
Dựa vào phương trình hóa học ta được:
nAl=23nH2=23⋅1,2=0,8molnAl=23nH2=23⋅1,2=0,8mol
Khối lượng AlAl tham gia phản ứng:
mAl=nAl.MAl=0,8.27=21,6gmAl=nAl.MAl=0,8.27=21,6g
c) Dựa vào phương trình hóa học ta được:
nAl2(SO4)3=13nH2=13⋅1,2=0,4molnAl2(SO4)3=13nH2=13⋅1,2=0,4mol
Khối lượng muối tạo thành:
mAl2(SO4)3=nAl2(SO4)3.MAl2(SO4)3=0,4.342=136,8gmAl2(SO4)3=nAl2(SO4)3.MAl2(SO4)3=0,4.342=136,8g
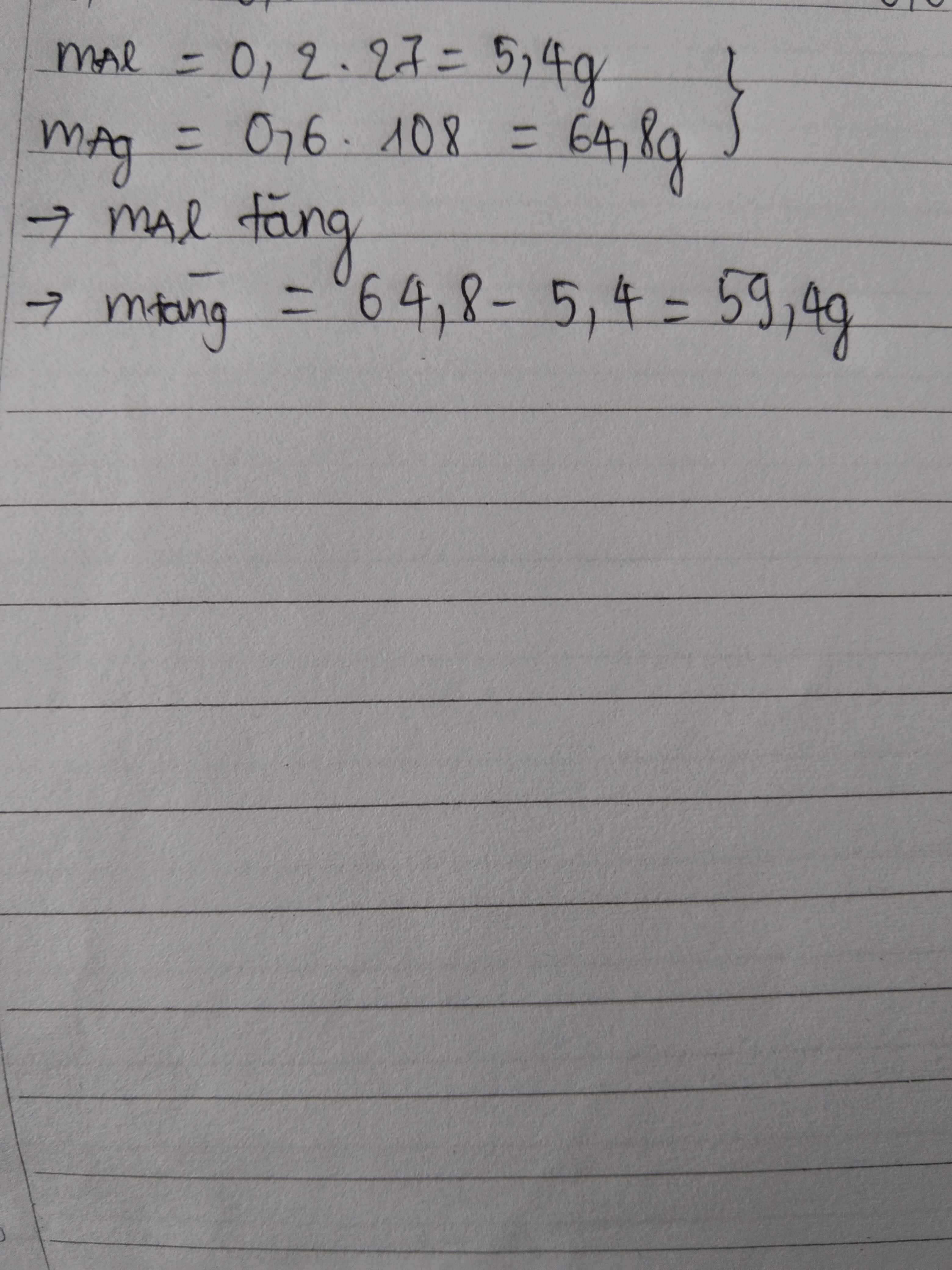
a)
$2Al + 3CuSO_4 \to Al_2(SO_4)_3 + 3Cu$
b)
Gọi $n_{Al\ pư} = a(mol)$
Theo PTHH : $n_{Cu} = \dfrac{3}{2}n_{Al\ pư} = 1,5a(mol)$
Ta có :
$64.1,5a - 27a = 2,07 \Rightarrow a = 0,03(mol)$
$m_{Al} = 0,03.27 = 0,81(gam)$
c)
$n_{CuSO_4} = n_{Cu} = 1,5a = 0,045(mol)$
$m_{CuSO_4} = 0,045.160 = 7,2(gam)$
\(2Al+3CuSO_4\rightarrow Al_2\left(SO_4\right)_3+3Cu\)
Gọi x là số mol Al phản ứng, ta có :
\(m_{KLgiam}=m_{Cu}-m_{Al}=64.\dfrac{3}{2}x-27x=2,07\)
=>x=0,03 (mol)
=> \(m_{Al}=0,03.27=0,81\left(g\right)\)
\(n_{muối}=\dfrac{1}{2}n_{Al}=0,015\left(mol\right)\)
=> \(m_{muối}=0,015.342=5,13\left(g\right)\)