Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Để dung dịch tồn tại thì các ion không phản ứng với nhau và định luật bảo toàn được thỏa mãn. Ở đây chỉ có đáp án B thỏa mãn.

Đáp án B
Loại ngay A và D do H+ và CO32- không tồn tại trong cùng 1 dung dịch
Xét B: nK+ + nNH4+ = 0,15 + 0,25 = 0,4 mol; nCl- + 2nCO32- = 0,1 + 2.0,15 = 0,4 mol
=> thỏa mãn định luật bảo toàn điện tích
Xét C: nK+ + 2nMg2+ = 0,15 + 2.0,1 = 0,35 mol; nCl- + 2nSO42- = 0,1 + 2.0,075 = 0,25 mol
=> không thỏa mãn định luật bảo toàn điện tích

Đáp án C
Nhận thấy Mg2+ và H+ không thể tồn tại cùng với CO32-
→Dung dịch A chứa K+, NH4+, CO32- và ion âm An-
Theo định luật bảo toàn điện tích: 0,15+ 0,25=0,15.2+ n.nAn-
→ n.nAn-= 0,1 mol → Anion còn lại trong dung dịch A là Cl-
→Dung dịch A chứa K+, NH4+, CO32- và Cl-
→mchất rắn khan= 0,15.39 + 0,25.18+ 0,15.60 + 0,1.35,5= 22,9 gam
Dung dịch B chứa H+, Mg2+, SO42- và NO3-
Chú ý khi cô cạn thì axit HNO3 (0,2 mol) sẽ bay hơi cùng nước
→mchất rắn khan= mMg2++ mSO4(2-)+ mNO3- dư
= 0,1.24+ 96.0,075+ 0,05.62=12,7 gam

Dung dịch X gồm :
$Mg^{2+} : 0,1$
$H^+ : 0,2$
$SO_4^{2-} : 0,075$
$NO_3^- : 0,25$
Dung dịch Y gồm :
$K^+ : 0,15$
$NH_4^+ : 0,25$
$CO_3^{2-} : 0,15$
$Cl^- : 0,1$

Áp dụng định luật bảo toàn điện tích: tổng số mol điện tích dương bằng tổng số mol điện tích âm
nên 2.0,05+ 0,15.1= 0,1.1+ 2x → x= 0,075 mol
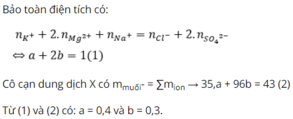
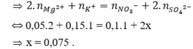
E. Đáp án khác.
B và D không được chọn vì \(Mg^{2+}+CO_3^{2-}\rightarrow MgCO_3\downarrow\)
A và C không tuân theo định luật bảo toàn điện tích.