Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

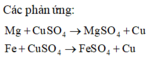
Dung dịch D gồm MgSO4 và FeSO4. Chất rắn B bao gồm Cu và Fe có thể dư
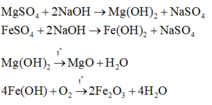
Gọi x, y là số mol Mg và Fe phản ứng. Sự tăng khối lượng từ hỗn hợp A (gồm Mg và Fe) so với hỗn hợp B (gồm Cu và Fe có thể dư) là
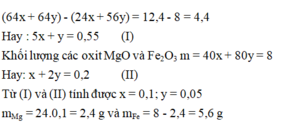
Đáp án C

Chia, tách nhỏ từng bài tập, quá trình ra để giải:
chỉ có Al + NaOH → NaAlO2 + 3/2H2
nNaOH = nH2 = 0,12 mol
⇒ chứng tử sau phản ứng NaOH còn dư 0,04 mol và ∑nAl trong A = 0,08 mol.
Khí B như ta biết gồm CO2 (sinh ra do FeCO3) và H2 (do Fe)
10 gam kết tủa là 0,1 mol CaCO3
⇒ có 0,1 mol CO2 ⇒ nFeCO3 = 0,1 mol.
Rắn R ra chắc chắn có Cu và có thể là còn dư kim loại Fe. Vậy phần trong dung dịch?
À, gồm: 0,08 mol AlCl3; 0,12 mol NaCl + ??? mol FeCl2. Mà ∑nHCl = nHCl = 0,74 mol
⇒ bảo toàn Cl có ngay nFeCl2 = 0,19 mol; sinh ra do 0,1 mol FeCO3 ⇒ còn 0,09 nữa do Fe.
Vậy mR = mCu, Fe lọc ra = 20 – mAl – mFeCO3 – mFe phản ứng = 1,2 gam.
R gồm Cu, Fe là các kim loại hoạt động TB yếu nên + HNO3 sinh NO hoặc NO2.
ở đây dùng HNO3 đặc nên khí duy nhất sinh ra là NO2 |
nNO2 = 0,05 mol
⇒ bảo toàn electron có 3nFe + 2nCu = nNO2 = 0,05 mol mà mFe + Cu = 1,2 gam
⇒ giải ra nFe = nCu = 0,01 mol. Đọc tiếp quá trình cuối
⇒ m gam sản phẩm gồm 0,01 mol CuO và 0,05 mol Fe2O3 ⇒ m = 1,6 gam
Đáp án B

Đáp án A
· Có n Al ( B ) = 2 3 . n H 2 = 2 3 . 0 , 672 22 , 4 = 0 , 02 mol
· Chất rắn thu được sau khi nung là Al2O3:
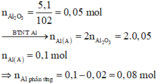
· Quy đổi A tương đương với hỗn hợp gồm 0,1 mol Al, a mol Fe, b mol O
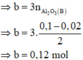
· Phần không tan D gồm Fe và oxit sắt + H2SO4 ® Dung dịch E + 0,12 mol SO2
Dung dịch E chứa một muối sắt duy nhất và không hòa tan được bột Cu
Þ Muối sắt là FeSO4.
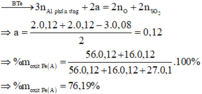

Bài này có thể giải theo kinh nghiệm, hoặc biện luận rào số mol hỗn hợp A.
Từ đó ⇒ giới hạn của chất rắn C
Trường hợp xả ra đó là:
Fe pứ hết và Cu chỉ pứ 1 phần ⇒ C gồm Ag và Cu chưa tan.
+ Sơ đồ ta có:
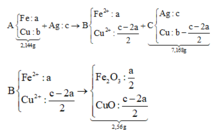
PT theo khối lượng oxit: 40c = 2,56 Û c = 0,064 mol
⇒ CM AgNO3 = 0,064 ÷ 0,2 = 0,32
Đáp án A

Đáp án A
Do Y tác dụng được với HCl nên Y chứa Fe dư ⇒ C u 2 + hết
Giả sử chỉ có Mg phản ứng ![]()
=> tăng giảm khối lượng ![]()
=> vô lý => Fe phản ứng
Bảo toàn khối lượng gốc kim loại:
24x + 56y = 9,2 + 0,13.64 - 12,48 => x = 0,07 mol; y = 0,06 mol
=> rắn gồm 0,07 mol MgO và 0,03 mol F e 2 O 3 => m = 7,6 (g)

Đáp án A
Do Y tác dụng được với HCl nên Y chứa Fe dư => C u 2 + hết
Giả sử chỉ có Mg phản ứng

Bảo toàn khối lượng gốc kim loại:
![]()
![]()
=> rắn gồm 0,07 mol MgO và 0,03 mol
![]()

Đáp án A
Do Y tác dụng được với HCl nên Y chứa Fe dư ⇒ C u 2 + hết
Giả sử chỉ có Mg phản ứng ![]()
=> tăng giảm khối lượng ![]()
=> vô lí => Fe phản ứng
Bảo toàn khối lượng gốc kim loại:
24x + 56y = 9,2 + 0,13.64 - 12,48 => x = 0,07 mol => m = 7,6(g)
=> rắn gồm 0,07 mol MgO và 0,03 F e 2 O 3 => m = 7,6 (g)

Chọn đáp án A.
« Trắc nghiệm: Y + HCl dư → 0,04 mol H2; khả năng cao nhất là do 0,04 mol Fe.
12,48 gam Y gồm 0,04 mol Fe + 0,13 mol Cu (từ dung dịch ra) + ? mol Cu ban đầu → ? = 0,03 mol.
Đơn giản lại quá trình:
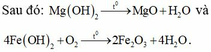
Ta có Z gồm 0,07 mol MgSO4 và 0,06 mol FeSO4 → Khi cho Z + NaOH thu được Mg(OH)2 và Fe(OH)2.
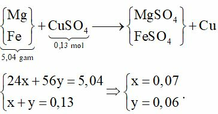
Suy ra m gam chất rắn gồm 0,07 mol MgO và 0,03 mol Fe2O3 → m=7,6 gam.
« Tự luận: cần lập luận chặt chẽ hơn chút. Đó là có thể Mg còn dư trong Y. Nhưng sẽ là dễ thấy ngay TH này không thỏa mãn. Thật vậy, khi đó Z chỉ chứa duy nhất 0,13 mol MgSO4.
→ BTKL phản ứng đầu có m=14,4 mâu thuẫn giả thiết.!
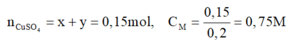
Hỗn hợp B gồm Cu và Fe dư. nCu = 0,15 mol; nFe = 0,1 - 0,05 = 0,05 mol.
Khi tác dụng với dung dịch HNO3: Theo phương pháp bảo toàn eletron
Chất khử là Fe và Cu
Chất oxi hoá là HNO3
Ta có 3a = 0,15 + 0,3; a = 0,15 (mol),
VNO = 0,15.22,4 = 3,36 (lít)
Đáp án B