
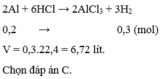
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

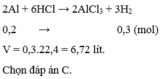

a)
$FeO + 2HCl \to FeCl_2 + H_2O$
$Fe + 2HCl \to FeCl_2 + H_2$
$2FeO + 4H_2SO_4 \to Fe_2(SO_4)_3 + SO_2 + 4H_2O$
$2Fe + 6H_2SO_4 \to Fe_2(SO_4)_3 + 3SO_2 + 6H_2O$
b)
n Fe = n H2 = 4,48/22,4 = 0,2(mol)
n SO2 = 7,84/22,4 = 0,35(mol)
Bảo toàn e :
n FeO + 3n Fe = 2n SO2
=> n FeO = 0,35.2 - 0,2.3 = 0,1(mol)
=> m = 0,1.72 + 0,2.56 = 18,4 gam

Câu 7: \(n_{Al}=\dfrac{2,7}{27}=0,1\left(mol\right);n_S=\dfrac{0,32}{32}=0,01\left(mol\right)\)
\(Al\rightarrow Al^{3+}+3e\) \(8H^++SO_4^{2-}+6e\rightarrow S+4H_2O\)
\(4H^++SO_4^{2-}+2e\rightarrow SO_2+2H_2O\)
Bảo toàn e : \(n_{SO_2}.2+n_S.6=n_{Al}.3\)
=> \(n_{SO_2}=\dfrac{0,1.3-0,01.6}{2}=0,12\left(mol\right)\)
=> \(V_{SO_2}=2,688\left(l\right)\)
\(n_{H_2SO_4}=\dfrac{0,01.8+0,12.4}{2}=0,28\left(mol\right)\)
Mình bị nhầm chỗ số mol H2SO4 nha
Sửa lại : \(n_{H^+}=4n_{SO_2}=0,6\left(mol\right)\)
Do H2SO4 ---------> 2H+ + SO42-
=> \(n_{H_2SO_4}=\dfrac{1}{2}n_{H^+}=0,3\left(mol\right)\)

Đáp án C
nAl = 0,2, nFe = 0,1 (mol)
2Al + 6HCl→ 2AlCl3 + 3H2
0,2 → 0,3 (mol)
Fe + 2HCl→ FeCl2 + H2
0,1 0,1 (mol)
V = (0,3+0,1).22,4 = 8,96 (l)

a, \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\\ n_{SO_2}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\)
PTHH:
Zn + H2SO4 (loãng) ---> ZnSO4 + H2
0,2<--------------------------------------0,2
Zn + 2H2SO4 (đặc) ---> ZnSO4 + SO2↑ + 2H2O
0,2--->0,4------------------------------->0,2
Cu + 2H2SO4 ---> CuSO4 + SO2↑ + 2H2O
0,2<--0,4<------------------------0,2
b, \(\left\{{}\begin{matrix}m_{Zn}=0,2.65=13\left(g\right)\\m_{Cu}=0,2.64=12,8\left(g\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{13}{13+12,8}.100\%=50,4\%\\\%m_{Cu}=100\%-50,4\%=49,6\%\end{matrix}\right.\)
c, PTHH:
SO3 + H2O ---> H2SO4
0,4<---------------0,4
2SO2 + O2 --to, V2O5--> 2SO3
0,4<---------------------------0,4
4FeS2 + 11O2 --to--> 2Fe2O3 + 8SO2
0,2<--------------------------------------0,4
=> \(m_{FeS_2}=\dfrac{0,2.120}{100\%-20\%}=30\left(g\right)\)