Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{H_2S}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
\(n_{SO_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Gọi số mol Mg là x (mol)
Mg0 - 2e --> Mg+2
x--->2x
S+6 + 8e --> S-2
1,2<--0,15
S+6 + 2e --> S+4
0,4<--0,2
Bảo toàn e: 2x = 1,6 (mol)
=> x = 0,8 (mol)
=> m = 0,8.24 = 19,2 (g)
bảo toàn Mg: nMgSO4 = 0,8 (mol)
=> m1 = 0,8.120 = 96 (g)

Ta có: \(n_{SO_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
\(n_S=\dfrac{4,8}{32}=0,15\left(mol\right)\)
Coi hh chất rắn gồm M và O.
⇒ nO = 0,15.2 = 0,3 (mol)
Ta có: \(n_M=\dfrac{16,2}{M_M}\left(mol\right)\)
BT e, có: n.nM = 2nO + 2nSO2 + 6nS
\(\Rightarrow\dfrac{16,2n}{M_M}=1,8\Rightarrow M_M=9n\left(g/mol\right)\)
Với n = 3 thì MM = 27 (g/mol) là thỏa mãn.
Vậy: M là Al.

Đáp án D.
nAl = 0,2 (mol), nCu = 0,1 (mol)
Áp dụng định luật bảo toàn electron có
![]()
→ V = 0,4 . 22,4 = 8,96 lít.

Đáp án B
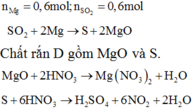
![]()
![]()
Khi cho Ba(OH)2 vào Y thu được kết tủa gồm Mg(OH)2 và BaSO4
![]()

a)
$FeO + 2HCl \to FeCl_2 + H_2O$
$Fe + 2HCl \to FeCl_2 + H_2$
$2FeO + 4H_2SO_4 \to Fe_2(SO_4)_3 + SO_2 + 4H_2O$
$2Fe + 6H_2SO_4 \to Fe_2(SO_4)_3 + 3SO_2 + 6H_2O$
b)
n Fe = n H2 = 4,48/22,4 = 0,2(mol)
n SO2 = 7,84/22,4 = 0,35(mol)
Bảo toàn e :
n FeO + 3n Fe = 2n SO2
=> n FeO = 0,35.2 - 0,2.3 = 0,1(mol)
=> m = 0,1.72 + 0,2.56 = 18,4 gam

Đáp án A.
Gọi nAl = a mol, nZn = b mol.

Ta có: 27a + 65b = 9,2 (*)
3a + 2b = 0,5 (**)
Giải (*), (**): a = b = 0,1 mol.
m muối = mKl + M gốc axit. ne/2
= 3,92 + 96. 0,25 = 33,2 g

Đáp án B
Khí thi được là
![]()
Cu là kim loại đứng sau hiđro trong dãy hoạt động hóa học, do đó Cu không tác dụng với dung dịch H 2 SO 4 loãng => Chất rắn không tan là Cu
Sơ đồ phản ứng:

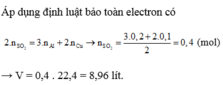

Câu 7: \(n_{Al}=\dfrac{2,7}{27}=0,1\left(mol\right);n_S=\dfrac{0,32}{32}=0,01\left(mol\right)\)
\(Al\rightarrow Al^{3+}+3e\) \(8H^++SO_4^{2-}+6e\rightarrow S+4H_2O\)
\(4H^++SO_4^{2-}+2e\rightarrow SO_2+2H_2O\)
Bảo toàn e : \(n_{SO_2}.2+n_S.6=n_{Al}.3\)
=> \(n_{SO_2}=\dfrac{0,1.3-0,01.6}{2}=0,12\left(mol\right)\)
=> \(V_{SO_2}=2,688\left(l\right)\)
\(n_{H_2SO_4}=\dfrac{0,01.8+0,12.4}{2}=0,28\left(mol\right)\)
Mình bị nhầm chỗ số mol H2SO4 nha
Sửa lại : \(n_{H^+}=4n_{SO_2}=0,6\left(mol\right)\)
Do H2SO4 ---------> 2H+ + SO42-
=> \(n_{H_2SO_4}=\dfrac{1}{2}n_{H^+}=0,3\left(mol\right)\)