Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có: nSO2=2,47922,4≈0,11(mol)nSO2=2,47922,4≈0,11(mol)
PTHH: SO2+Ba(OH)2−−−>BaSO3↓+H2OSO2+Ba(OH)2−−−>BaSO3↓+H2O
Theo PT: nBaSO3=nSO2=0,11(mol)nBaSO3=nSO2=0,11(mol)
=> mBaSO3=0,11.217=23,87(g)

n Ba(OH)2 = 2.0,2=0,4 mol
\(Ba\left(OH\right)_2+SO_2->BaSO_3+H_2O\)
0,4 ................0,4...........0,4
m BaSO3 = 0,4. ( 138+32+16.3)=87,2 g
v SO2 = 0,4.22,4=8,96 lít
m BaSO3 = 0,4. ( 137+32+16.3)=86,8 g
xin lũi nha mình nhìn nhầm bạn thông cảm

a) \(n_{SO_2}=\dfrac{6,1975}{24,79}=0,25\left(mol\right)\)
PTHH: SO2 + Ba(OH)2 → BaSO3 + H2O
Mol: 0,25 0,25 0,25
b) \(m_{BaSO_3}=0,25.217=54,25\left(g\right)\)
c) \(V_{ddBa\left(OH\right)_2}=\dfrac{0,25}{22}=\dfrac{1}{88}\left(l\right)\)

500ml=0.5l
nBaOH2 =0.5 x1=0.5 mol
MH2SO4=500.15%=75g
nH2SO4= xấp xỉ 0.8mol
H2SO4 dư tính theo BaOH2
pthh: Ba(OH)2 + H2SO4 => BaSO4+H2O
Theo pthh nBaSO4= nBa(OH)2=0.5mol
=>m kết tủa= 0.5x233=116.5g
theo pthh nH2SO4 phản ứng=nBaOH2= 0.5 mol
=> nH2SO4 Dư=0.8-0.5=0.3 mol
=>
m dư=0.3x98=29.4g
mH2SO4 đã dùng là m phản ứng? nếu thế thì m đã dung là 75-29.4=45.6
còn nếu m đã dùng là m chất tan thi là 75g như trên =))


Chọn A
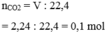
Vì Ba( O H ) 2 dư do đó chỉ xảy ra phản ứng tạo kết tủa
PTHH:
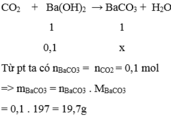
Ta có: \(n_{SO_2}=\dfrac{2,479}{22,4}\approx0,11\left(mol\right)\)
PTHH: \(SO_2+Ba\left(OH\right)_2--->BaSO_3\downarrow+H_2O\)
Theo PT: \(n_{BaSO_3}=n_{SO_2}=0,11\left(mol\right)\)
=> \(m_{BaSO_3}=0,11.217=23,87\left(g\right)\)