Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bài 1:
TN1: moxit = 78,4 (g)
Gọi số mol H2SO4 pư là a (mol)
=> \(n_{H_2O}=a\left(mol\right)\) (Bảo toàn H)
Theo ĐLBTKL: \(m_{oxit}+m_{H_2SO_4}=m_{muối}+m_{H_2O}\)
=> 78,4 + 98a = 190,4 + 18a
=> a = 1,4 (mol)
=> \(n_O=n_{H_2O}=1,4\left(mol\right)\)
=> mkim loại = moxit - mO = 78,4 - 1,4.16 = 56 (g)
TN2:
Gọi \(\left\{{}\begin{matrix}n_{HCl}=x\left(mol\right)\\n_{H_2SO_4}=y\left(mol\right)\end{matrix}\right.\)
Bảo toàn H: \(n_{H_2O}=\dfrac{x+2y}{2}=1,4\left(mol\right)\)
=> x + 2y = 2,8 (1)
Có: \(m_{muối}=m_{kim.loai}+m_{Cl}+m_{SO_4}\)
=> 175,4 = 56 + 35,5x + 96y
=> 35,5x + 96y = 119,4 (2)
(1)(2) => x = 1,2; y = 0,8
Vậy số mol H2SO4 trong Y là 0,8 (mol)
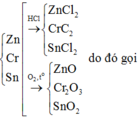
Bài 2:
Gọi số mol Fe trong 15,8 gam X là a (mol)
TN1:
Bảo toàn Fe: \(n_{FeCl_2}=a\left(mol\right)\)
\(n_{H_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
=> nHCl = 1,2 (mol)
Theo ĐLBTKL: mkim loại + mHCl = mmuối + mH2
=> mmuối = 15,8 + 1,2.36,5 - 0,6.2 = 58,4 (g)
TN2:
Bảo toàn Fe: \(n_{FeCl_3}=a\left(mol\right)\)
Khối lượng muối tăng: 61,95 - 58,4 = 3,55 (g)
=> \(m_{FeCl_3}-m_{FeCl_2}=3,55\)
=> 162,5a - 127a = 3,55
=> a = 0,1 (mol)
\(\%m_{Fe}=\dfrac{0,1.56}{15,8}.100\%=35,443\%\)

A
Đặt công thức chung của hai kim loại kiềm là R, khối lượng mol trung bình của chúng là M .
Chọn số mol của R tham gia phản ứng là 1 mol.
Phương trình phản ứng
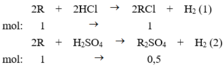

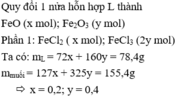

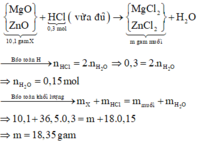



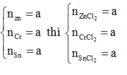


Ta có:
m hh phần 1 = m hh phần 2 = 38,6 ( g )
Phần 1
Gọi n HCL phản ứng = a ( mol )
=> n H2O = 0,5a ( mol )
BTKL: 38,6 + 36,5a = 78,2 + 9a
=> a = 1,44 ( mol ) => n O ( hh phần 1 ) = 0,72 ( mol )
=> m O ( hh phần 1 ) = 11,52 ( g ) => m KL ( hh phần 1 ) = 27,08 ( g )
Phần 2
Quy hh phần 2 về: RO
PTHH
RO + 2HCl ===> RCL2 + H2O ( 1 )
RO + H2SO4 ===> RSO4 + H2O ( 2)
Gọi n RO ( 1 ) = x ( mol ) ; n RO ( 2 ) = y ( mol )
CÓ: m gốc CL + m gốc SO4 = 88,7 - 27,08 = 61,62 ( g )
Ta có hpt
\(\left\{{}\begin{matrix}x+y=0,72\\2x\times35,5+96y=61,62\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,3\\y=0,42\end{matrix}\right.\)
Có: y = 0,42 ( mol ) = > n H2SO4 = 0,42 ( mol )