Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Zn\left(OH\right)_2\left(mp\right)}=\dfrac{19.8}{99\cdot2}=0.1\left(mol\right)\)
\(a.\)
\(n_{H_2SO_4}=0.15\left(mol\right)\)
\(Zn\left(OH\right)_2+H_2SO_4\rightarrow ZnSO_4+2H_2O\)
Lập tỉ lệ :
\(\dfrac{0.1}{1}< \dfrac{0.15}{1}\) \(\Rightarrow H_2SO_4dư\)
\(m_{ZnSO_4}=0.1\cdot161=16.1\left(g\right)\)
\(b.\)
\(n_{NaOH}=0.15\left(mol\right)\)
\(2NaOH+Zn\left(OH\right)_2\rightarrow Na_2ZnO_2+2H_2O\)
Lập tỉ lệ :
\(\dfrac{0.15}{2}< \dfrac{0.1}{1}\Rightarrow Zn\left(OH\right)_2dư\)
\(n_{Na_2ZnO_2}=\dfrac{1}{2}n_{NaOH}=\dfrac{1}{2}\cdot0.15=0.075\left(mol\right)\)
\(m=0.075\cdot143=10.725\left(g\right)\)

Chọn đáp án C
+ Ta có
nH3PO4 p1 = nNaOH ÷ 3 = 0,1
⇒ nH3PO4 p1 + p2 = 0,1×2 = 0,2 mol
Ta có: 0,2 mol H3PO4 + 0,3 mol NaOH
→ mMuối + mH2O
nH2O = nOH/NaOH = 0,3 mol
⇒ mH2O = 5,4 gam
BTKL ⇒
mMuối = 0,2×98 + 0,3×40 – 5,4
= 26,2 gam

Số mol H2 thu được ở phần 2 lớn hơn phần 1, nên trong phản ứng với H2O của hỗn hợp X thì vẫn còn Al chưa phản ứng
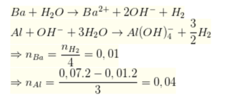
Lượng HCl lớn nhất cần dùng
n H C l = 0 , 03 + 0 , 02 + 4 ( 0 , 04 - 0 , 02 ) = 0 , 13 ⇒ v = 130 m l

b) n\(_{Al\left(OH\right)3}=0,2\left(mol\right)\)
Al(OH)3 + NaOH--->NaAlO2 +2H2O
Ta có
n\(_{NaOH}=0,05.2=0,1\left(mol\right)\)
=> Al(OH)3 dư
Theo pthh
n\(_{NaAlO2}=n_{NaOH}=0,1\left(mol\right)\)
m\(_{NaAlO2}=82.0,1=8,2\left(g\right)\)

a) nNaOH= 0,15(mol) ; nH3PO4= 0,1(mol)
Ta có: 1< 0,15/0,1 <2
=> Sản phẩm thu được là hỗn hợp 2 muối: NaH2PO4 và Na2HPO4
a) PTHH: NaOH + H3PO4 -> NaH2PO4 + H2O
x____________x__________x(mol)
2 NaOH + H3PO4 -> Na2HPO4 + 2 H2O
y_______0,5y_________0,5y(mol)
b) Ta có hpt:
\(\left\{{}\begin{matrix}x+y=0,15\\x+0,5y=0,1\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,05\\y=0,1\end{matrix}\right.\)
=> m(muối)=mNaH2PO4 + mNa2HPO4= 120.0,05+142.0,1.0,5=13,1(g)
c) Vddmuoi= VddNaOH+ VddH3PO4= 0,1+0,1=0,2(l)
=> CMddNaH2PO4= 0,05/0,2=0,25(M)
CMddNa2HPO4=(0,1.0,5)/0,2=0,25(M)

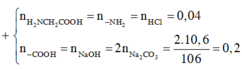
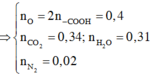



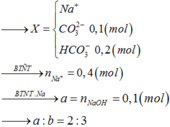
nAl(OH)3= 15.6/78=0.2 mol
PI : nH2SO4= 0.2 mol
2Al(OH)3 + 3H2SO4 --> Al2(SO4)3 + 6H2O
Bđ: 0.2_________0.2
Pư : 1/15________0.2_________1/15
Kt: 2/15_________0___________1/15
mAl2(SO4)3= 1/15*342= 22.8g
PII:
nNaOH = 0.05 mol
NaOH + Al(OH)3 --> NaAlO2 + 2H2O
Bđ: 0.05_____0.2
Pư: 0.05_____0.05______0.05
Kt: 0________0.15______0.05
mNaAlO2= 0.05*82=4.1g
a) \(n_{H_2SO_4}=0,2\times1=0,2\left(mol\right)\)
\(m_{Al\left(OH\right)_3}=\frac{1}{2}\times15,6=7,8\left(g\right)\)
\(\Rightarrow n_{Al\left(OH\right)_3}=\frac{7,8}{78}=0,1\left(mol\right)\)
PTHH: 2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 6H2O
Theo PT: \(n_{Al\left(OH\right)_3}=\frac{2}{3}n_{H_2SO_4}\)
Theo bài: \(n_{Al\left(OH\right)_3}=\frac{1}{2}n_{H_2SO_4}\)
Vì \(\frac{1}{2}< \frac{2}{3}\) ⇒ H2SO4 dư
Theo PT: \(n_{Al_2\left(SO_4\right)_3}=\frac{1}{2}n_{Al}=\frac{1}{2}\times0,1=0,05\left(mol\right)\)
\(\Rightarrow m_{Al_2\left(SO_4\right)_3}=0,05\times342=17,1\left(g\right)\)
b) \(n_{NaOH}=0,05\times1=0,05\left(mol\right)\)
\(m_{Al\left(OH\right)_3}=\frac{1}{2}\times15,6=7,8\left(g\right)\)
\(\Rightarrow n_{Al\left(OH\right)_3}=\frac{7,8}{78}=0,1\left(mol\right)\)
PTHH: Al(OH)3 + NaOH → NaAlO2 + 2H2O
Theo PT: \(n_{Al\left(OH\right)_3}=n_{NaOH}\)
Theo bài : \(n_{Al\left(OH\right)_3}=2n_{NaOH}\)
Vì \(2>1\) → Al(OH)3 dư
Theo Pt: \(n_{NaAlO_2}=n_{NaOH}=0,05\left(mol\right)\)
\(\Rightarrow m_{NaAlO_2}=0,05\times82=4,1\left(g\right)\)