Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Phương pháp: thử 5 hóa chất hữu dụng: Ba(OH)2, H2SO4, AgNO3, Quì, HCl
|
|
NH4Cl |
(NH4)2SO4 |
NaNO3 |
| Ba(OH)2 |
↑NH3 Mùi khai |
↑NH3 Mùi khai BaSO4 ↓trắng |
x |
|
|
MgCl2 |
FeCl2 |
FeCl3 |
|
|
Mg(OH)2 Trắng |
Fe(OH)2 xanh |
Fe(OH)3 Nâu đỏ |
|
|
Al(NO3)3 |
|
|
|
|
Al(OH)3 Trắng sau đó tan dần |
|
|

- Dùng quỳ tím
+) Hóa xanh: NaOH
+) Không đổi màu: Các dd còn lại
- Đổ dd NaOH vào các dd còn lại
+) Xuất hiện kết tủa: MgSO4
PTHH: \(2NaOH+MgSO_4\rightarrow Na_2SO_4+Mg\left(OH\right)_2\downarrow\)
+) Không hiện tượng: NaCl và BaCl2
- Đổ dd MgSO4 vào 2 dd còn lại
+) Xuất hiện kết tủa: BaCl2
PTHH: \(BaCl_2+MgSO_4\rightarrow MgCl_2+BaSO_4\downarrow\)
+) Không hiện tượng: NaCl

Dùng Ba(OH)2
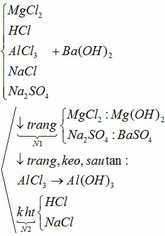
Lấy ngẫu nhiên 1 lọ thuộc nhóm (2) nhỏ vào kết tủa của nhóm (1). Có 2 TH xảy ra:
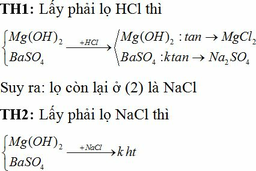
Suy ra: lọ lấy ở (2) là NaCl → lọ còn lại ở (2) là HCl. Dùng HCl nhận biết MgCl2 và Na2SO4 dựa vào kết tủa của chúng như TH1.
Pt: MgCl2 + Ba(OH)2 → BaCl2 + Mg(OH)2↓
Na2SO4 + Ba(OH)2 → 2NaOH + BaSO4↓
2HCl + Ba(OH)2 → BaCl2 + 2H2O
Mg(OH)2 + 2HCl → MgCl2 + 2H2O

- Cách 1: Sử dụng NaOH.
+ Nếu có kết tủa màu trắng xanh, sau đó hóa nâu trong không khí thì chất ban đầu là F e C l 2 :
F e C l 2 + 2 N a O H → F e O H 2 ↓ + 2 N a C l
4 F e O H 2 + O 2 + 2 H 2 O → 4 F e O H 3 ↓
+ Nếu có kết tủa trắng thì chất ban đầu là M g C l 2 :
M g C l 2 + 2 N a O H → M g O H 2 ↓ + 2 N a C l
- Cách 2: Nhúng thanh kim loại Mg vào dd muối F e C l 2 , kim loại mạnh sẽ đẩy kim loại yếu ra khỏi muối → Xảy ra phản ứng, kim loại bị đẩy ra sẽ bám vào thanh kim loại. Ta cân khối lượng thanh kim loại trước vào sau khi nhúng vào dd sẽ thấy sự thay đổi khối lượng của nó → Có xảy ra phản ứng → Nhận biết 2 muối.
⇒ Chọn D.

- Lấy mỗi chất một ít làm mẫu thử và đánh STT.
- Nhúng quỳ tím vao các mẫu thử.
+ Mẫu làm quỳ hóa đỏ: HCl, H2SO4
+ Mẫu làm quỳ hóa xanh: Ba(OH)2, NaOH
+ Mẫu không làm quỳ đổi màu: NaCl, BaCl2
- Lấy một trong 2 axit cho tác dụng với muối:
TH1: Trong các mẫu muối không phản ứng => Axit đã dùng là HCl => Axit còn lại là H2SO4.
Cho axit H2SO4 tác dụng với muối.
+ Mẫu không phản ứng: NaCl
+ Mẫu phản ứng, tạo kết tủa trắng: BaCl2
\(BaCl_2+H_2SO_4\rightarrow BaSO_4\downarrow+2HCl\)
Cho axit H2SO4 tác dụng với các bazo.
+ Mẫu phản ứng nhưng không có hiện tượng đặc trưng: NaOH
+ Mẫu phản ứng, tạo kết tủa trắng: Ba(OH)2
\(H_2SO_4+2NaOH\rightarrow Na_2SO_4+2H_2O\)
\(H_2SO_4+Ba\left(OH\right)_2\rightarrow BaSO_4\downarrow+2H_2O\)
TH2: Trong các mẫu muối có một mẫu phản ứng, tạo kết tủa trắng => Mẫu muối đó là BaCl2 => Mẫu muối còn lại là NaCl, mẫu axit đã dùng là H2SO4 => Mẫu axit còn lại là HCl. (Phương trình tương tự bên trên)
Tương tự cho axit H2SO4 tác dụng với bazo như trên để nhận biết 2 bazo còn lại.
- Cho NaOH tác dụng với các dung dịch:
+ Không hiện tượng: NaCl, BaCl2 (1)
+ Có khí mùi khai thoát ra: NH4Cl
\(NH_4Cl+NaOH->NaCl+NH_3+H_2O\)
+ Xuất hiện kết tủa trắng xanh, hóa nâu sau 1 thời gian: FeCl2
\(FeCl_2+2NaOH->Fe\left(OH\right)_2\downarrow+2NaCl\)
\(4Fe\left(OH\right)_2+O_2+2H_2O->4Fe\left(OH\right)_3\downarrow\)
+ Xuất hiện kết tủa trắng: Ba(HCO3)2, MgCl2 (2)
\(Ba\left(HCO_3\right)_2+2NaOH->Na_2CO_3+BaCO_3\downarrow+2H_2O\) (*)
\(MgCl_2+2NaOH->Mg\left(OH\right)_2\downarrow+2NaCl\)
- Đun nóng dung dịch ở (2)
+ Sủi bọt khí, xuất hiện kết tủa trắng:
\(Ba\left(HCO_3\right)_2\underrightarrow{t^o}BaCO_3\downarrow+CO_2\uparrow+H_2O\)
+ Không hiện tượng: MgCl2
- Lọc kết tủa của dung dịch thu được từ (*), ta thu được dung dịch Na2CO3. Cho dd Na2CO3 tác dụng với dung dịch ở (1)
+ Không hiện tượng: NaCl
+ Xuất hiện kết tủa trắng: BaCl2
\(BaCl_2+Na_2CO_3->BaCO_3\downarrow+2NaCl\)