Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bài 7:
\(n_{Fe}=\dfrac{1000}{55,85}\left(mol\right)\)
Trong 1 kg sắt thì khối lượng electron là:
\(m_e=\dfrac{1000}{55,85}.26.9,1094.10^{-28}\approx4240,723.10^{-28}\left(g\right)\approx4240,723.10^{-31}\left(kg\right)\)
Bài 8:
\(m_{Ne}=20,179.0,16605.10^{-23}=3,35072295.10^{-23}\left(g\right)\)

$n_{Al} = 54 : 27 = 2(mol)$
Số nguyên tử Al là $2.6.10^{23} = 12.10^{23}$ nguyên tử
Số hạt electron là : $13.12.10^{23} = 156.10^{23}$ hạt
Khối lượng electron :$m_e = 9,1.10^{-31}.156.10^{23} = 1,4196.10^{-5}$(gam)$

nFe = 1000 : 55,85 ≈ 179,051 mol
→ Số hạt electron trogn 1 kg Fe = Số hạt proton có trong 1kg Fe = 179,051 x 26 x 6,023 x 1023 = 2,804 x 1027 hạt.
→ melectron có trong 1kg Fe = 2,804 x 1027 x 9,1094 x 10-31 = 2,554. 10-3 kg.
Đáp án C

Đáp án D.
n Fe = 5 , 6 56 = 0 , 1 mol
0.1 mol sắt → 0.1.6,022.1023 = 6.022.1022 nguyên tử sắt
Số electron = 6.022.1022.26=1.56572.1024 e

ĐÁP ÁN D
nFe = 0,1 mol → số nguyên tử Fe = 0,1.6,022.1023 = 6,022.1022
Số hạt p = 26. 6,022.1022 =15,66.1023.

\(n_{Fe}=\dfrac{5,6}{56}=0,1mol\)
\(0,1\) mol sắt \(\rightarrow0,1.6,022.10^{23}=6,022.10^{22}\)nguyên tử sắt
Số electron \(=6,002.10^{22}.26=1,56572.10^{24}\) electron
a)
1 electron có khối lượng = 9,11.10^-28 gam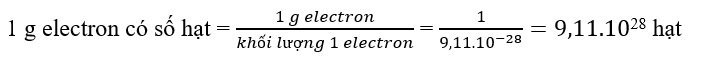
b)
1 electron có khối lượng = 9,11.10^-28 gam
1 mol electron có 6,022x10^23 hạt electron
=> Khối lượng 1 mol electron = 9,11.10^-28 x 6,022x10^23 = 5,49.10^-4 gam