Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi số mol của Ba, Al và Mg lần lượt là x, y và z mol
Lượng khí thu được khi cho A vào nước dư ít hơn khi cho A vào xút dư nên khi cho A vào nước dư thì Ba phản ứng hết, Al phản ứng một phần. Khi cho A vào xút dư thì cả Ba và Al đều phản ứng hết.
Cho A tác dụng với nước dư có phản ứng:
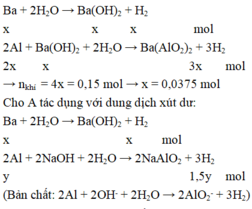

Khối lượng của A là: m = 0,0375.137 + 0,175.27 + 0,1.24 = 12,2625 gam.
⇒ Chọn B

TN1: A tác dụng với nước
Ba +2 H2O --> Ba(OH)2 + H2;
x ------------------x------------x ;
2Al + Ba(OH)2 +2 H2O --> Ba(AlO2)2 +3 H2;
2x--------x---------------------------------------3x;
TN2 : A tác dụng với dd xút
Ba +2 H2O --> Ba(OH)2 + H2;
x----------------------------------x;
2Al + Ba(OH)2 +2 H2O --> Ba(AlO2)2 +3 H2;
y-------------------------------------------------3/2y;
TN3: A tác dụng với HCl
Ba + 2HCl --> BaCl2 + H2;
x------------------------------x;
2Al + 6HCl --> 2AlCl3 + 3H2;
y------------------------------3/2y;
Mg + 2HCl --> MgCl2 + H2;
z------------------------------z;
Gọi x,y,z lần lượt là số mol của Ba, Al, Mg.
TN1: nH2= 3,36/22,4= 0,15 (mol)
=>x + 3x= 4x=0,15 => x= 0,0375 (mol)
TN2: nH2= 0,3 (mol)
=> x + 3/2 y = 0,3 => y = 0,175 (mol)
TN3: nH2= 0,4 (mol)
=> x +3/2y + z = 0,4 => Z= 0,1 (mol)
m= 0,0375*137+ 0,175*27+ 0,1*24=26,2625(g).

Bài 1:
n H2=5.6/22.4=0.25(mol)
Zn + H2SO4  ZnSO4 + H2
ZnSO4 + H2
0.25 0.25
m Zn=0.25*65=16.25(g)
m hh=16.25+6.25=22.5(g)
% Zn=16.25/22.5*100%=72.22%
% Ag=100%-72.22%=27.78%
Bài 2:
-
nH2 = 6,72/22,4 = 0,3 mol
gọi x,y lần lượt là số mol của Mg và Zn tham gia phản ứng.
Mg + 2HCl MgCl2 + H2
MgCl2 + H2
x 2x x
Zn + 2HCl ZnCl2 + H2
ZnCl2 + H2
y 2y y
Ta có phương trình
x + y = 0,3
24x + 56y = 15,3
=> x = 0,102 ; y = 0.198
m Mg = 0,102.24 = 2,448 g
m Zn = 0,198.65 = 12.87 g
n HCl = 2.0,102+2.0,198 = 0,6 mol
V HCl = 0,6/1 = 0,6 lít.Bài 3:
TN1
n H2=3.36/22.4=0.15(mol)
Ba + 2H2O Ba(OH)2 + H2
Ba(OH)2 + H2
0.15 0.15
TN2
n H2 = 6.72/22.4=0.3(mol)
2Al + 2NaOH + 2H2O 2NaAlO2 + 3H2
2NaAlO2 + 3H2
0.2 0.3
TN3
n H2=8.96/22.4=0.4(mol)
Ba + 2HCl BaCl2 + H2
BaCl2 + H2
0.15 0.15
2Al + 6HCl 2AlCl3 + 3H2
2AlCl3 + 3H2
0.2 0.2
Mg + 2HCl MgCl2 + H2
MgCl2 + H2
0.05 0.05
m Ba=0.15*137=20.55(g)
m Al=0.2*27=5.4(g)
m Mg=0.05*24=1.2(g)
m=20.55+5.4+1.2=27.15
%Ba=20.55/27.15*100%=75.69%
%Al=5.4/27.15*100%=19.89%
%Mg=100%-75.69%-19.89%=4.42%

TN1:Cho A t/d với H2O
Ba+ H2O -------> Ba(OH)2+ H2 (1)
a........a......................a.............a
Ba(OH)2+ 2Al + 2H2O-------> Ba(AlO2)2+ 3H2(2)
a................2a........2a.......................a..............3a
TN2:Cho A t/d với xút dư (NaOH) => Al hết
Ba+ 2H2O -----> Ba(OH)2+ H2(3)
a........2a...................a.............a
NaOH+ Al+ H2O ------> NaAlO2+ 3/2H2(4)
b...........b.......b.....................b............1.5b
TN3:Cho A t/d với HCl vừa đủ
Ba+ 2HCl -------> BaCl2+ H2(5)
a........2a...................a.........a
2Al+ 6HCl --------> 2AlCl3+ 3H2(6)
b..........3b.....................b.........1.5b
Mg+ 2HCl ---------> MgCl2+ H2(7)
c..........2c.......................c..........c
(Khi Al t/d với dd kiềm hoặc kiềm thổ thì nH2=3/2nAl
Nếu TN1 và TN2 Al p/ư vừa đủ thì VH2 ở 2 pt phải bằng nhau
Mà VH2(TN1)<VH2(TN2)=> Al ở TN1 dư=> tính theo Ba(OH)2
nH2(TN1)=0.15 mol
nH2(TN2)=0.3 mol
nH2(TN3)=0.55 mol
Đặt a, b, c là số mol Ba, Al, Mg
Khi đó theo pt(1)& (2) =>nH2=a+3a=0.15mol=>a=0.0375 (I)
Theo pt(3), (4) nH2=a+1.5b=0.3 (II)
Theo pt(5), (6), (7) nH2=a+1.5b+c=0.55 (III)
Giải hệ pt (I), (II), (III) =>a=0.0375 mol, b=0.175 mol, c=0.25 mol
=> m= 0.0375*137+0.175*27+0.25*24=15.8625 g
Do đó
%mBa=(0.0375*137*100)/15.8625=32.39%
%mAl=(0.175*27*100)/15.8625=29.79%
%mMg=37.82%

1.
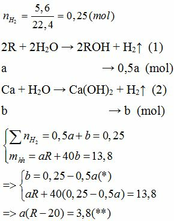
Vì b > 0, từ (*) => a < 0,25/0,5 = 0,5 thế vào (**)
=> R – 20 > 7,6
=> R > 27,6 (***)
Khi cho 8,58 gam R tác dụng với lượng dư HCl thì lượng H2 thoát ra lớn hơn 2,24 (lít)
2R + 2HCl → 2RCl + H2↑ (3)
Theo PTHH (3):
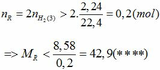
Từ (***) và (****) => 27, 6 < MR < 42,9
Vậy MR = 39 (K) thỏa mãn
2.
Ta có:
=> nKOH = nK = 0,2 (mol)
nCa(OH)2 = nCa = 0,15 (mol)
∑ nOH- = nKOH + 2nCa(OH)2 = 0,2 + 2.0,15 = 0,5 (mol)
Khi cho hỗn hợp Z ( N2, CO2) vào hỗn hợp Y chỉ có CO2 phản ứng
CO2 + OH- → HCO3- (3)
CO2 + 2OH- → CO32- + H2O (4)
CO32- + Ca2+ → CaCO3↓ (5)
nCaCO3 = 8,5/100 = 0,085 (mol) => nCO32-(5) = nCaCO3 = 0,085 (mol)
Ta thấy nCaCO3 < nCa2+ => phương trình (5) Ca2+ dư, CO32- phản ứng hết
TH1: CO2 tác dụng với OH- chỉ xảy ra phản ứng (4)
Theo (4) => nCO2 = nCO32-(4) = nCaCO3 = 0,085 (mol)
=> VCO2(đktc) = 0,085.22,4 = 1,904 (lít)
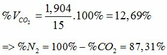
TH2: CO2 tác dụng với OH- xảy ra cả phương trình (3) và (4)
Theo (4): nCO2 = nCO32- = 0,085 (mol)
nOH- (4) = 2nCO32- = 2. 0,085 = 0,17 (mol)
=> nOH- (3)= ∑ nOH- - nOH-(4) = 0,5 – 0,17 = 0,33 (mol)
Theo PTHH (3): nCO2(3) = nOH- = 0,33 (mol)
=> ∑ nCO2(3+4) = 0,085 + 0,33 = 0,415 (mol)
=> VCO2 (ĐKTC) = 0,415.22,4 = 9,296 (lít)
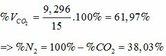

\(n_{H_2}=\dfrac{4,928}{22,4}=0,22mol\)
\(n_{CuSO_4}=0,66.0,5=0,33mol\)
- Gọi số mol trong phần I là :Fe(x mol), Al(y mol), Ag(z Mol)
- Sỗ mol mỗi kim loại trong phần II: Fe(tx mol), Al(ty mol), Ag(tz Mol)
56(x+tx)+27(y+ty)+108(z+tz)=24,5(*)
- Phần I: Fe+2HCl\(\rightarrow\)FeCl2+H2(1)
2Al+6HCl\(\rightarrow\)2AlCl3+3H2(2)
x+1,5y=0,22(**)
- Phần II: Fe+CuSO4\(\rightarrow\)FeSO4+Cu(3)
2Al+3CuSO4\(\rightarrow\)Al2(SO4)3+3Cu(4)
tx+1,5ty=0,33(***)
152tx+171ty=39,9(****)
- Kết hợp(***) và(****) : tx=0,06, ty=0,18
\(y=3x\)(*****)
- kết hợp (**) và (*****) ta có: x=0,04, y=0,12
\(\rightarrow t=\dfrac{0,06}{0,04}=1,5\)
- Thay x=0,04 ,y=0,12 , t=1,5 vào (*) ta có z=0,04
mI=56x+27y+108z=56.0,04+27.0,12+108.0,04=9,8 gam
số mol Cu=tx+1,5ty=0,33 mol
chất rắn Z gồm 0,33 mol Cu và tz=0,04.1,5=0,06 mol Ag
mZ=0,33.64+0,06.108=27,6 gam
 =)))
=)))
\(A\)tác dụng với nước
\(Ba+2H2O\Leftrightarrow Ba\left(OH\right)2+H2\)
\(2Al+Ba\left(OH\right)2+2H2O\Leftrightarrow Ba\left(AlO2\right)2+3H\)
\(Ba+2H2O\Leftrightarrow Ba\left(OH\right)2+H2\)
\(2Al+Ba\left(OH\right)2+2H2O\Leftrightarrow Ba\left(AlO2\right)2+3H\)
\(A\)tác dụng với \(HCl\)
\(Ba+2HCl\Leftrightarrow BaCl2+H2\)
\(2Al+6HCl\Leftrightarrow2AlCl3+3H2\)
\(Mg+2HCl\Leftrightarrow MgCl2+H2\)
Gọi \(x,y,z\)lần lượt là số \(mol\)của \(Ba,Al,Mg\)
\(nH2=\frac{3,36}{22,4}=0,15mol\)
\(\Rightarrow x+3x=4x=0,15\Rightarrow x=0,0375mol\)
\(nH2=0,3mol\)
\(\Rightarrow x+\frac{3}{2y}=0,3\Rightarrow y=0,175mol\)
\(nH2=0,4mol\)
\(\Rightarrow x+\frac{3}{2y}+z=0,4\Rightarrow z=0,1mol\)
\(m=0,0375.137+0,175.27=0,1.24=26,2625g\)
@Hoàng_Tuấn