Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

trong phòng thí nghiệm
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 8H2O + 5Cl2
KClO3 + 6HCl → KCl + 3H2O + 3Cl2
trong công nghiệp
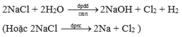
2NaCl → 2Na + Cl2
2NaCl + 2H2O → H2 + 2NaOH + Cl2

Bài 1 (B)HCl có thể td với những chất : Al; Mg(OH)2;FeS;Fe2O3;Ag2SO4;K2O;CaCO3
\(2Al+6HCl\rightarrow2AlCl_3+3H_2O\)
\(Mg\left(OH\right)_2+2HCl\rightarrow MgCl_2+2H_2O\)
\(FeS+2HCl\rightarrow FeCl_2+H_2S\)
\(Fe_2O_3+6HCl\rightarrow2FeCl_3+3H_2O\)
Lưu ý : Ag2SO4 là một chất ít tan.Tuy nhiên nếu đã ở dạng dd thì Ag2SO4 vẫn có khả năng phản ứng với HCl
Ag2SO4+HCl-->AgCl+H2SO4
AgCl màu trắng kết tủa
\(K_2O+2HCl\rightarrow2KCl+H_2O\)
\(CaCO_3+2HCl\rightarrow CaCl_2+CO_2+H_2O\)
PTHH chứng tỏ Clo có tính oxh :
\(Cl_2+2Na\rightarrow2NaCl\)
\(Cl_2+Mg\rightarrow MgCl_2\)
\(Cl_2+H_2-^{as}\rightarrow2HCl\)
PTHH chứng tỏ Clo có tính khử :
\(Cl_2+H_2O\overrightarrow{\leftarrow}HCl+HClO\)
\(Cl_2+2NaOH\rightarrow NaCl+NaClO+H_2O\)
\(3Cl_2+6NaOH-^{t^o}\rightarrow5NaCl+NaClO_3+3H_2O\)

- Sản xuất clo trong CN:
- Điều chế HCl trong PTN theo pp sunfat:

a) Phương pháp điều chế Clo trong phòng thí nghiệm:
+Đun nóng nhẹ dung dịch axit clorua đậm đặc với chất có khả năng oxy hóa mạnh như mangan dioxit (MnO2).-->dùng trong hòng thí nghiệm
+ dùng một số chất oxy hóa khác như kali pemanganat (KMnO4), Kali Clorat (KClO3), Clorua vôi (CaOCl2)-->dùng trong phòng thí nghiệm
+ tiến hành điện phân muối Natri Clorua bằng điện phân nóng chảy theo phương trình phản ứng Hoặc điện phân có màng ngăn dung dịch muối halogenua (natri clorua)--->trong công nghiệp
b) nước Javen
2NaOH+Cl2--->NaClO+NaCl+H2O
Clorua vôi
Ca(OH)2+Cl--->CaOCl2+H2O
Kaliclorat
2KCl+3O2--->2KClO3

MnO2+4HCl->MnCl2+Cl2+H2O
Fe+2HCl->FeCl2+H2
2Fe+3CL2-to>2Fecl3
b)
2NaCl+2H2O-đp\comn>2NaOH+cl2+H2
H2+Cl2-as->2HCl
Cl2+2NaOH->NaCl+NaClO+H2O
a, Fe + 2HCl ---> FeCl2 + H2
MnO2 + 4HCl ---> MnCl2 + Cl2 + 2H2O
2Fe + 3Cl2 ---to---> 2FeCl3
b, 2NaCl ---đpnc---> 2Na + Cl2
2H2O ---đp---> 2H2 + O2
H2 + Cl2 ---as---> 2HCl
2Na + 2H2O ---> 2NaOH + H2
2NaOH + Cl2 ---đpkcmn---> NaCl + NaClO + H2O
Những chất mình in đậm là nữngc chất cần điều chế nha

a) Nước Gia-ven:
\(2NaCl+H_2O\underrightarrow{đpkmn}NaCl+NaClO+H_2\)
b) Clorua vôi
\(2NaCl+2H_2O\underrightarrow{đpcmn}2NaOH+H_2+Cl_2\)
\(Cl_2+Ca\left(OH\right)_2\rightarrow CaOCl_2+H_2O\)
c)
\(6KOH+3Cl_2\underrightarrow{t^o}5KCl+KClO_3+3H_2O\)

\(MnO_2+4HCl_{dac}\rightarrow MnCl_2+Cl_2+H_2O\)
\(Cao+H_2O\rightarrow Ca\left(OH\right)_2\)
\(Ca\left(OH\right)_2+Cl_2\rightarrow CaOCl_2+H_2O\) (điều kiện ở 20 độ C)
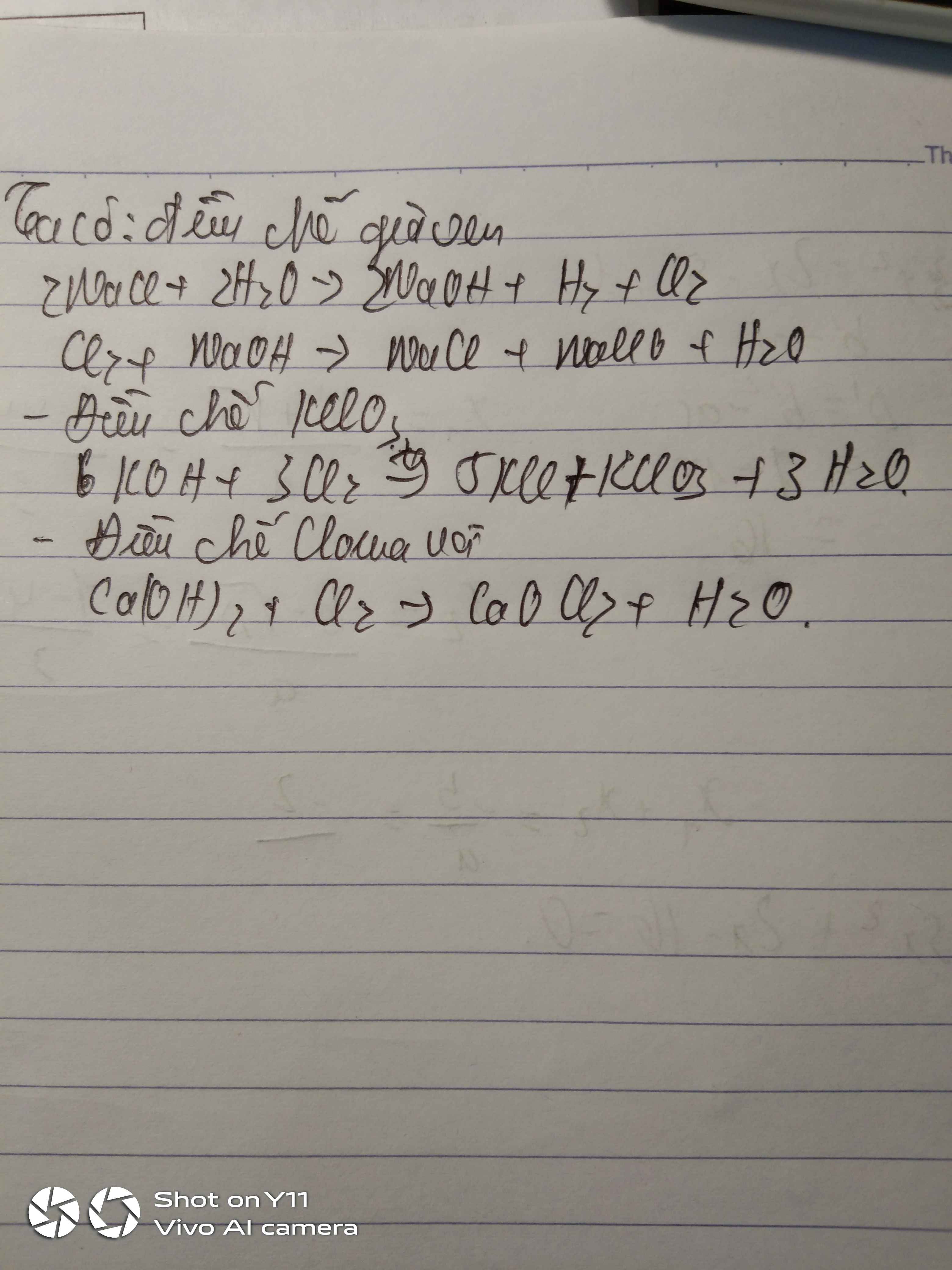
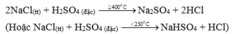
1. \(NaCl+H_2SO_4\rightarrow NaHSO_4+HCl\)
2. Khí HCl thu được trong quá trình điều chế axit HCl
3. \(2NaCl+2H_2O\rightarrow H_2O+2NaOH+Cl_2\)
\(2NaOH+Cl_2\rightarrow NaCl+NaClO+H_2O\)
4. \(Ca\left(OH\right)_2+Cl_2\rightarrow CaOCl_2+H_2O\)
5. \(6KOH+3Cl_2\rightarrow KClO_3+5KCl+3H_2O\)
6. \(MnO_2+4HCl\rightarrow MnCl_2+Cl_2+2H_2O\)
7.\(2NaCl+2H_2O\rightarrow2NaOH+Cl_2+H_2O\)
8.\(H_2SO_4+CaF_2\rightarrow CaSO_4+HF\)
9. \(NaBr\rightarrow Na+\frac{1}{2}Br_2\)
10.\(NaI\underrightarrow{^{đpnc}}Na+\frac{1}{2}I_2\)