Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bài 1 :
Oxít sắt chứ không phải oxi sắt nha
nFe = \(\dfrac{2,24}{56}\) = 0,04 ( mol )
2xFe + yO2 \(\rightarrow\) 2FexOy
0,04...................\(\dfrac{0,04}{x}\)
=> \(\dfrac{0,04}{x}\) = \(\dfrac{3,2}{56x+16y}\)
Ta có 1 \(\le\) x \(\le\) 3
=> Lập bảng
| x | 1 | 2 | 3 |
| y | 1,5 | 3 | 4,5 |
| loại | nhận | loại |
=> CTHC là Fe2O3
Ta có \(\dfrac{m_{Fe3O4}}{m_{CuO}}=\dfrac{3}{1}\)
=> mFe3O4 = 3mCuO
mà mFe3O4 + mCuO = 24
=> 3mCuO + mCuO = 24
=> mCuO = 6 ( gam )
=> nCuO = \(\dfrac{6}{80}\) = 0,075 ( mol )
=> mFe3O4 = 24 - 6 = 18 ( gam )
=> nFe3O4 = \(\dfrac{18}{232}\) \(\approx\) 0,0776 ( mol )
Fe3O4 + 4H2 \(\rightarrow\) 3Fe + 4H2O
0,0776.................0,2328
=> mFe = 0,2328 . 56 = 13,0368 ( gam )
CuO + H2 \(\rightarrow\) Cu + H2O
0,075...........0,075
=> mCu = 0,075 . 64 = 4,8 ( gam )

a)
\(2KMnO_4\rightarrow K_2MnO_4+MnO_2+O_2\)
\(n_{O2}=\frac{8,92}{22,4}=0,4\left(mol\right)\)
nKMnO4 tham gia=0,8 mol
nKMnO4 =nban đầu=\(\frac{64,78}{158}=0,41\left(mol\right)\)
Bạn xem lại đề nhé : O2 thu được lớn hơn O2 theo PT

\(a,PTHH:2KClO_3\xrightarrow{t^o}2KCl+3O_2\\ b,n_{KClO_3(thực tế)}=\dfrac{36,75}{122,5}=0,3(mol)\\ n_{O_2(phản ứng)}=\dfrac{6,72}{22,4}=0,3(mol)\\ \Rightarrow n_{KClO_3(phản ứng)}=\dfrac{2}{3}n_{O_2}=0,2(mol)\\ \Rightarrow H\%=\dfrac{0,2}{0,3}.100\%=66,67\%\\ c,n_{KCl}=n_{KClO_3(phản ứng)}=0,2(mol)\\ \Rightarrow m_{KCl}=0,2.74,5=14,9(g)\)

a) Gọi số mol H2 là x
=> \(n_{H_2O}=x\left(mol\right)\)
Theo ĐLBTKL: \(m_A+m_{H_2}=m_B+m_{H_2O}\)
=> 200 + 2x = 156 + 18x
=> x = 2,75 (mol)
=> \(V_{H_2}=2,75.22,4=61,6\left(l\right)\)
b) Gọi \(\left\{{}\begin{matrix}n_{CuO}=a\left(mol\right)\\n_{Fe_2O_3}=1,5a\left(mol\right)\\n_{Al_2O_3}=b\left(mol\right)\end{matrix}\right.\)
=> 80a + 240a + 102b = 200
=> 320a + 102b = 200
PTHH: CuO + H2 --to--> Cu + H2O
a---------------->a
Fe2O3 + 3H2 --to--> 2Fe + 3H2O
1,5a------------------>3a
=> 64a + 168a + 102b = 156
=> 232a + 102b = 156
=> a = 0,5; b = \(\dfrac{20}{51}\)
=> \(\left\{{}\begin{matrix}\%m_{CuO}=\dfrac{0,5.80}{200}.100\%=20\%\\\%m_{Fe_2O_3}=\dfrac{0,75.160}{200}.100\%=60\%\\\%m_{Al_2O_3}=\dfrac{\dfrac{20}{51}.102}{200}.100\%=20\%\end{matrix}\right.\)
c) \(n_{H_2}=\dfrac{2,75}{5}=0,55\left(mol\right)\)
\(n_{FeO\left(tt\right)}=\dfrac{36}{72}=0,5\left(mol\right)\)
Gọi số mol FeO phản ứng là t (mol)
PTHH: FeO + H2 --to--> Fe + H2O
t--------------->t
=> 56t + (0,5-t).72 = 29,6
=> t = 0,4 (mol)
=> \(H\%=\dfrac{0,4}{0,5}.100\%=80\%\)

\(n_{Fe_2O_3}=\dfrac{3,2}{160}=0,02mol\)
\(n_{Cu}=\dfrac{8}{80}=0,1mol\)
\(Fe_2O_3+3H_2\rightarrow\left(t^o\right)2Fe+3H_2O\)
0,02 0,06 0,04 ( mol )
\(CuO+H_2\rightarrow\left(t^o\right)Cu+H_2O\)
0,1 0,1 0,1 ( mol )
\(m_{Fe}=0,04.56=2,24g\)
\(m_{Cu}=0,1.64=6,4g\)
\(n_{H_2}=0,06+0,1=0,16mol\)
\(n_{Fe_2O_3}=\dfrac{3,2}{160}=0,02mol\)
\(m_{CuO}=\dfrac{8}{80}=0,1mol\)
\(Fe_2O_3+3H_2\rightarrow2Fe+3H_2O\)
\(CuO+H_2\rightarrow Cu+H_2O\)
\(m_{Fe}=0,02\cdot2\cdot56=2,24g\)
\(m_{Cu}=0,1\cdot64=6,4g\)
\(\Sigma n_{H_2}=0,02\cdot3+0,1=0,16mol\Rightarrow V_{H_2}=3,584l\)
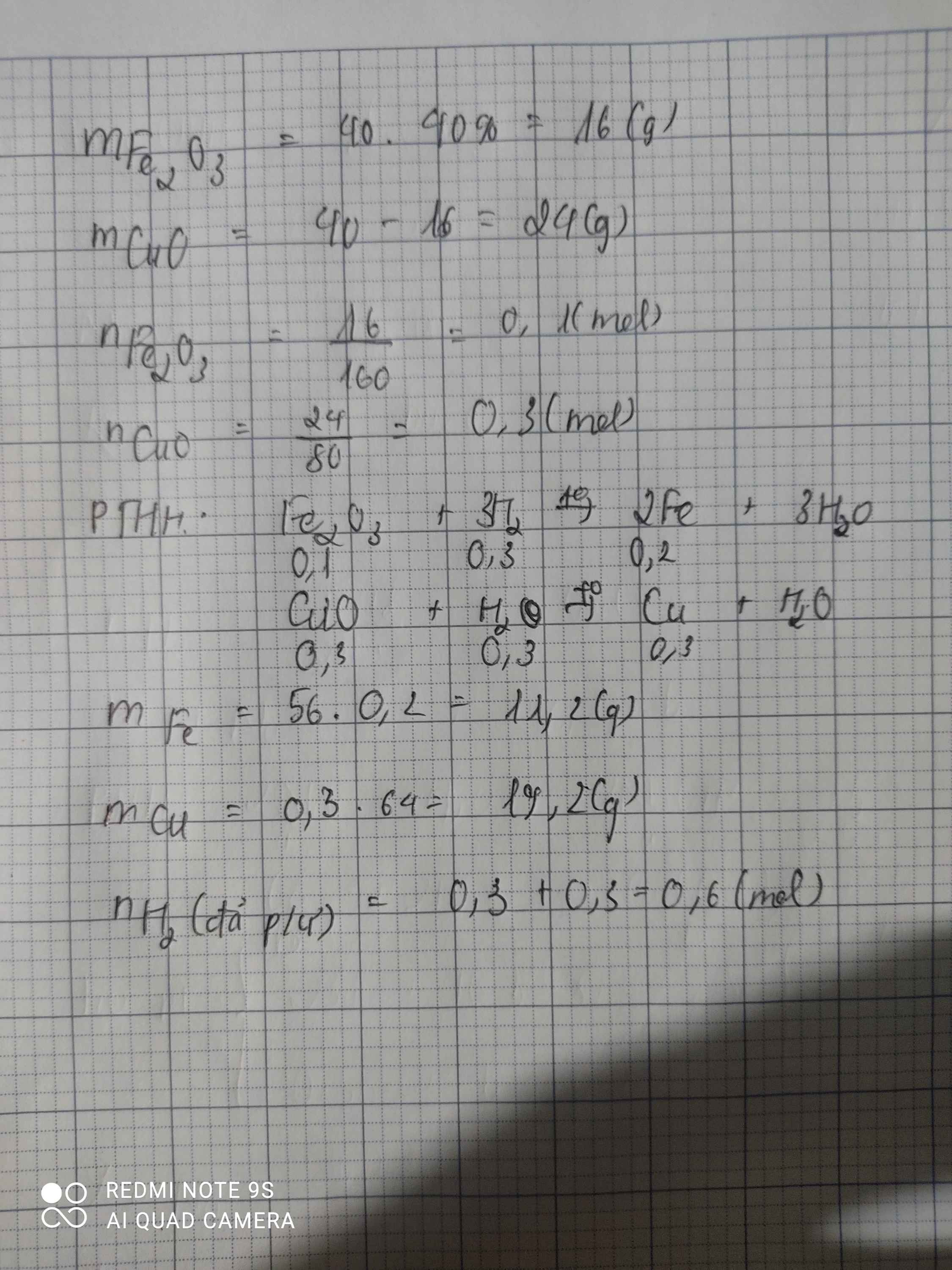
ê cậu ơi MKMnO4= 158 (g/mol) mà cậu đâu phải là 142 đâu .