Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Sửa đề 200ml dd HCl
\(a,n_{HCl}=0,2.0,1=0,02\left(mol\right)\)
PTHH: \(NaOH+HCl\rightarrow NaCl+H_2O\)
0,02<----0,02
\(C_{M\left(NaOH\right)}=\dfrac{0,02}{0,5}=0,04M\)
b) Muối thu được là NaCl phản ứng được với H2O, AgNO3
\(2NaCl+2H_2O\xrightarrow[\text{có màng ngăn}]{\text{điện phân}}2NaOH+Cl_2\uparrow+H_2\uparrow\\ NaCl+AgNO_3\rightarrow AgCl\downarrow+NaNO_3\)

Trong dd ban đầu:
K+_____a mol
Mg2+___b mol
Na+____c mol
Cl-_____a + 2b + c mol
mhhbđ = 74.5a + 95b + 58.5c = 24.625 g______(1)
nAgNO3 = 0.3*1.5 = 0.45 mol
Cho Mg vào A có phản ứng (theo gt) nên Ag(+) còn dư, Cl(-) hết. Rắn C gồm Ag và có thể cả Mg còn dư nữa. Thật vậy, khi cho rắn C vào HCl loãng thì khối lượng rắn bị giảm đi, chính do Mg pư, Ag thì không. Vậy mrắn C giảm = mMg chưa pư với A = 1.92 g.
=> nMg dư = 1.92/24 = 0.08 mol
=> nMg pư với A = 2.4/24 - 0.08 = 0.02 mol________(*)
Khi cho Mg vào A có pư:
Mg + 2Ag(+) ---> 2Ag(r) + Mg(2+)
0.02__0.04
=> nAg(+) pư với dd ban đầu = 0.45 - 0.04 = 0.41 mol
Ag(+) + Cl(-) ---> AgCl(r)
0.41___0.41
Có: nCl(-) = a + 2b + c = 0.41_____________(2)
Trong các cation trên, Mg(2+) và Ag(+) có pư với OH(-), tuy nhiên trong D chỉ có Mg(2+) nên kết tủa là Mg(OH)2:
Mg(2+) + 2OH(-) ---> Mg(OH)2
Khi nung:
Mg(OH)2 ---> MgO + H2O
Ta có: nMg(2+)trongD = nMgO = 4/40 = 0.1 mol
Trong đó 0.02 mol Mg(2+) được thêm vào bằng cách cho kim loại Mg vào (theo (*)), vậy còn lại 0.08 mol Mg(2+) là thêm từ đầu, ta có:
b = 0.08 mol_________________________(3)
(1), (2), (3) => a = 0.15, b = 0.08, c = 0.1
mKCl = 74.5*0.15 = 11.175 g
mMgCl2 = 95*0.08 = 7.6 g
mNaCl = 58.5*0.1 = 5.85 g

\(m_{AgNO3}=200.17\%=34\left(g\right)\)
\(\Rightarrow n_{AgNO3}=\frac{35}{170}=0,2\left(mol\right)\)
\(m_{NaCl}=300.2,925\%=8,775\left(g\right)\)
\(\Rightarrow n_{NaCl}=\frac{8,775}{58,5}=0,15\left(mol\right)\)
\(AgNO_3+NaCl\rightarrow AgCl+NaNO_3\)
0,15_______0,15______0,15______0,15
Sau phản ứng AgNO3 hết ( tính theo NaCl)
\(n_{AgCl}=n_{NaCl}=0,15\left(mol\right)\)
\(\Rightarrow m_{AgCl}=0,15.143,5=21,525\left(g\right)\)
\(m_{dd\left(spu\right)}=m_{NaCl}+m_{AgNO3}-n_{AgCl}\)
\(=34+8,775-21,525=21,25\left(g\right)\)
\(n_{AgNO3\left(dư\right)}=0,2-0,15=0,05\left(mol\right)\)
\(m_{AgNO3\left(dư\right)}=0,05.170=8,5\left(g\right)\)
\(C\%_{AgNO3\left(dư\right)}=\frac{8,5}{21,25}.100\%=40\%\)
\(m_{NaNO3}=0,15.85=12,75\left(g\right)\)
\(\Rightarrow C\%_{NaNO3}=\frac{12,75}{21,25}.100\%=60\%\)

\(n_{ZnCl_2}=\dfrac{200.13,6\%}{136}=0,2\left(mol\right)\\ a,ZnCl_2+2AgNO_3\rightarrow Zn\left(NO_3\right)_2+2AgCl\downarrow\\ b,n_{AgNO_3}=n_{AgCl}=0.2.2=0,4\left(mol\right)\\ n_{Zn\left(NO_3\right)_2}=n_{ZnCl_2}=0,2\left(mol\right)\\ m_{ddZn\left(NO_3\right)_2}=200+200-0,4.143,5=342,6\left(g\right)\\ C\%_{ddZn\left(NO_3\right)_2}=\dfrac{189.0,2}{342,6}.100\approx11,033\%\)

nHCl=(200.14,6%)/100=0,8(mol)
nBa(OH)2=(17,1%.200)/100=0,2(mol)
PTHH: Ba(OH)2 +2 HCl -> BaCl2 + 2 H2O
Ta có: 0,8/2 > 0,2/1
=> HCl dư, Ba(OH)2 hết=> Tính theo nHCl
=> nBaCl2=nBa(OH)2=0,2(mol) => mBaCl2= 208.0,2= 41,6(g)
nHCl(dư)=0,8 - 0,2.2=0,4(mol) => mHCl(dư)=0,4.36,5=14,6(g)
mddsau= 200+200=400(g)
C%ddBaCl2=(41,6/400).100=10,4%
C%ddHCl(dư)= (14,6/400).100=3,65%
Chúc em học tốt!
sai r bạn ơi tại sao nHCl=(200.14,6%)/100=0,8(mol) phải là 29.2 chứ

\(\text{1. BaCO3-->BaO+Co2}\)
\(\text{ MgCO3-->MgO+CO2}\)
Đặt số mol BaCO3 và MgCO3 là a và b
Ta có :
\(\left\{{}\begin{matrix}\text{197a+84b=3.23}\\\text{153a+40b=2.13}\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}\text{a=0.01}\\\text{ b=0.015}\end{matrix}\right.\)
\(\text{->%mBaCO3=0.01*197/3.23=60.99%}\)
\(\text{%mMgCO3=39.11%}\)
\(\text{nCO2=a+b=0.025 nCaCO3=0.02}\)
\(\text{CO2+Ca(OH)2-->CaCO3+H2O}\)
x ...............x.....................x
\(\text{2CO2+Ca(OH)2-->Ca(HCO3)2 }\)
y..............0.5y......................... y
\(\text{x+y=0.025}\Rightarrow\text{x=0.02}\)
->x=0.02 y=0.005
-->nCa(OH)2=0.0225-->cM Ca(OH)2=0.0225/0.5=0.045
2.Thiếu đề
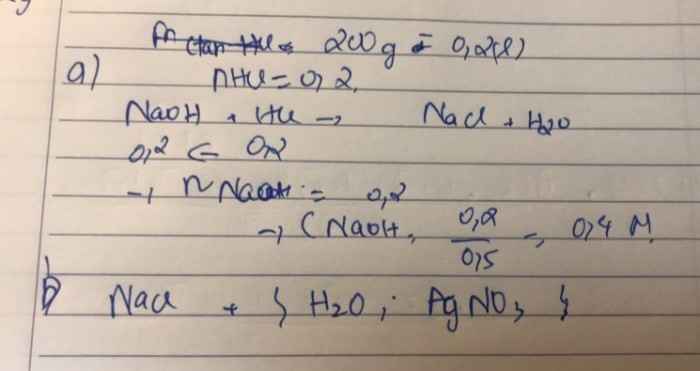

a)
Cho tác dụng với NaOH dư
Kết tủa xanh dương là CuCl2
Kết tủa nâu đỏ FeCl3
Kết tủa trắng rồi tan là AlCl3
Không phản ứng là KCl
b)
Cho quỳ tím vào 4 dd
- Hóa xanh là Ba(OH)2 và NạOH
- Không đổi màu là Na2CO3 và NaCl
Cho 2 nhóm tác dụng với H2SO4
- Có kết tủa là Ba(OH)2 còn lại là NaoH
- Có khi thoát ra là Na2CO3 còn lại là NaCl
c)
Cho một lượng nhỏ các chất td dd HCl dư, có khí bay ra là K2CO3
Cho 3 chất còn lại td với BaCl2, có kết tủa trắng : K2SO4
2 chất còn lại cho td với dd AgNO3, có kết tủa trắng : KCl, còn lại là AgNO3
2)
\(\left\{{}\begin{matrix}n_{HCl}=0,2\left(mol\right)\\n_{AgNO3}=0,22\left(mol\right)\end{matrix}\right.\)
Nên AgNO3 dư
\(\Rightarrow m_{dd\left(spu\right)}=200+220-m_{kt}=391,3\left(g\right)\)
\(C\%_{HNO3}=\frac{0,2.63}{391,3}=3,22\%\)
\(C\%_{AgNO3\left(dư\right)}=\frac{0,02.170}{391,3}=0,87\%\)