Hòa tan hoàn toàn 26 gam kẽm vào dung dịch axit Clohidric a viết phương trình hóa học của phản ứng b tính khối lượng HCl cần dùng c tính thể tích khí hidro ( điều kiện tiêu chuẩn) thu được sau phản ứng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a. \(n_{Zn}=\dfrac{6.5}{65}=0,1\left(mol\right)\)
PTHH : Zn + 2HCl -> ZnCl2 + H2
0,1 0,2 0,1
b. \(V_{H_2}=0,1.22,4=2,24\left(l\right)\)
c. \(m_{HCl}=0,2.36,5=7,3\left(g\right)\)
\(n_{Zn}=\dfrac{6,5}{65}=0,1mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,1 0,2 0,1
\(V_{H_2}=0,1\cdot22,4=2,24l\)
\(m_{HCl}=0,2\cdot36,5=7,3g\)

\(a.Zn+2HCl\rightarrow ZnCl_2+H_2\\ b.n_{Zn}=\dfrac{65}{65}=1\left(mol\right)\\ n_{ZnCl_2}=n_{Zn}=1\left(mol\right)\\ \Rightarrow m_{ZnCl_2}=1.136=136\left(g\right)\\ c.n_{H_2}=n_{Zn}=1\left(mol\right)\\ \Rightarrow V_{H_2}=1.22,4=22,4\left(l\right)\)

\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
n H2 = \(\dfrac{6,72}{22,4}=0,3\) (mol)
=> n Zn = n H2 = 0,3 mol
=> m Zn = 0,3.65= 19,5 (g)

\(n_{HCl}=0,2.2=0,4\left(mol\right)\\ a.Zn+2HCl\rightarrow ZnCl_2+H_2\\ b.0,2........0,4.......0,2.......0,2\left(mol\right)\\ m=m_{Zn}=0,2.65=13\left(g\right)\\ c.m_{ZnCl_2}=136.0,2=27,2\left(g\right)\\ d.V_{H_2\left(đktc\right)}=0,2.22,4=4,48\left(l\right)\)

\(a.Mg+2HCl\rightarrow MgCl_2+H_2\\ 2Al+6HCl\rightarrow2AlCl_3+3H_2\\ b.Đặt:\left\{{}\begin{matrix}n_{Mg}=x\left(mol\right)\\n_{Al}=y\left(mol\right)\end{matrix}\right.\\ n_{H_2}=\dfrac{18,48}{22,4}=0,825\left(mol\right)\\ Tacó:\left\{{}\begin{matrix}24x+27y=17,1\\x+\dfrac{3}{2}y=0.825\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}x=0,375\\y=0,3\end{matrix}\right.\\ \Rightarrow\%m_{Mg}=\dfrac{0,375.24}{17,1}.100=52,63\%\\ \%m_{Al}=47,37\%\)

a. Zn + 2HCl → ZnCl2 + H2
b. nZn = n\(_{ZnCl_2}\) =\(\dfrac{13}{65}=0,2\left(mol\right)\) => m\(_{ZnCl_2}\)= 0,2.136 = 27,2(g)
c. n\(_{H_2}\)= nZn = 0,2 (mol) => V\(_{H_2}\)=0,2.22,4 = 4,48 (lít)
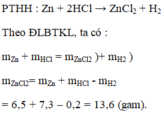
\(n_{Zn}=\dfrac{26}{65}=0.4\left(mol\right)\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(0.4.......0.8....................0.4\)
\(m_{HCl}=0.8\cdot36.5=29.2\left(g\right)\)
\(V_{H_2}=0.4\cdot22.4=8.96\left(l\right)\)