trộn a gam Fe3O4 với 16 gam FexOy được hỗn hợp rắn y để khử hoàn toàn hỗn hợp y cần dùng hết 11,2 lít khí H2(đktc) và thu được 19,6 gam Fe a) viết các phương trình hóa học xảy ra .tính giá trị của a b) xác định công thức hóa học của FexOy
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(Fe_3O_4+4H_2\underrightarrow{t^o}3Fe+4H_2O\)
\(Fe_xO_y+yH_2\underrightarrow{t^o}xFe+yH_2O\)
Ta có: \(n_{H_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
Theo PT: \(n_{H_2O}=n_{H_2}=0,5\left(mol\right)\)
Theo ĐLBT KL, có: mFe3O4 + mFexOy + mH2 = mFe + mH2O
⇒ a = mFe3O4 = 19,6 + 0,5.18 - 0,5.2 - 16 = 11,6 (g)
\(\Rightarrow n_{Fe_3O_4}=\dfrac{11,6}{232}=0,05\left(mol\right)\)
Có: \(n_{Fe}=\dfrac{19,6}{56}=0,35\left(mol\right)\)
Theo PT: \(n_{Fe}=3n_{Fe_3O_4}+x.n_{Fe_xO_y}\Leftrightarrow0,35=3.0,05+x.n_{Fe_xO_y}\Rightarrow n_{Fe_xO_y}=\dfrac{0,2}{x}\left(mol\right)\)
\(\Rightarrow M_{Fe_xO_y}=\dfrac{16}{\dfrac{0,2}{x}}=80x\left(g/mol\right)\)
Mà: \(M_{Fe_xO_y}=56x+16y\left(g/mol\right)\)
\(\Rightarrow56x+16y=80x\Rightarrow\dfrac{x}{y}=\dfrac{2}{3}\)
Vậy: CTHH cần tìm là Fe2O3

\(n_{CaCO_3}=n_{MgCO_3}=a\left(mol\right)\\ CaCO_3-^{^{t^{^0}}}->CaO+CO_2\\ MgCO_3-^{^{t^{^0}}}->MgO+CO_2\\ CaO+H_2O->Ca\left(OH\right)_2\\ C:MgO\\ n_C=a=n_{MgCO_3}=\dfrac{20}{40}=0,5mol\\ x=0,5\left(100+84\right)=92\left(g\right)\\ V_{CO_2}=y=22,4.2a=22,4\left(L\right)\)

Đáp án : B
, nFe = 0,2 ; nFe3O4 = 0,1 mol
, nH2 = 0,12 mol => 0,08 mol Fe phản ứng với Fe3+
=>sau phản ứng có : 0,46 mol Fe2+ và 0,04 mol Fe3+ ; 1,04 mol Cl-
Ag+ + Cl- -> AgCl
Ag+ + Fe2+ -> Fe3+ + Ag
=> kết tủa gồm : 1,04 mol AgCl và 0,46 mol Ag
=> m = 198,92g

$n_{Al} = 0,2(mol) ; n_{Fe_3O_4} = 0,075(mol)$
$8Al + 3Fe_3O_4 \xrightarrow{t^o} 9Fe + 4Al_2O_3$
Vì $n_{Al} : 8 = n_{Fe_3O_4} : 3$ nên gọi hiệu suất là a
Suy ra: $n_{Al\ pư} = 0,2a(mol) ; n_{Al\ dư} = 0,2 - 0,2a(mol)$
$n_{Fe} = \dfrac{9}{8}n_{Al} = 0,225a(mol)$
Mà :
$n_{H_2} = 1,5n_{Al} + n_{Fe} = 1,5(0,2 - 0,2a) + 0,225a = \dfrac{5,376}{22,4}$
$\Rightarrow a = 0,8 = 80\%$

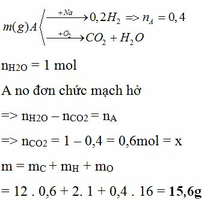
Cần nx ko bạn
k ạ mik giải r=)