Đốt cháy m gam Fe trong oxi, sau phản ứng thu được hỗn hợp rắn chứa 0,012mol Fe;
0,12mol FeO; 0,01mol Fe3O4 và 0,01mol Fe2O3. Tính m.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi \(n_{Fe}=x\left(mol\right)\Rightarrow m_{Fe}=56x\left(g\right)\)
\(n_{Mg}=3x\left(mol\right)\Rightarrow m_{Mg}=72x\left(g\right)\)
\(m_{Fe}+m_{Mg}=3,2\)
=>\(56x+72x=3,2\)
\(\Rightarrow128x=3,2\)
\(\Rightarrow x=0,025\)
\(3Fe+2O2-->Fe3O4\)
0,025------------------1/120(mol)
\(2Mg+O2-->2MgO\)
0,075------------------0,075(mol)
\(m_{hh}=\frac{1}{120}.232+0,075.40=\frac{74}{15}\left(g\right)\)
\(\%m_{Fe3O4}=\frac{\frac{29}{15}}{\frac{74}{15}}.100\%=38,67\%\)
\(\%m_{MgO}=100-38,67=61,33\%\)

Gọi $n_{Al}= a(mol) ; n_{Fe} = b(mol) \Rightarrow 27a + 56b = 4,44(1)$
$4Al + 3O_2 \xrightarrow{t^o} 2Al_2O_3$
$3Fe + 2O_2 \xrightarrow{t^o} Fe_3O_4$
$Fe_3O_4 + 4H_2 \xrightarrow{t^o} 3Fe + 4H_2O$
B gồm : $Al_2O_3, Fe$
$n_{Al_2O_3} = \dfrac{1}{2}n_{Al} = 0,5a(mol)$
Suy ra: $0,5a.102 + 56b = 5,4(2)$
Từ (1)(2) suy ra a = 0,04 ; b = 0,06
$m_{Al} = 0,04.27 =1,08\ gam$
$m_{Fe} = 0,06.56 = 3,36\ gam$

Nhận thấy sau khi qua HNO3 thì tất cả Fe đều chuyển về Fe3+ . Như vậy trạngthái đầu là Fe, trạng thái cuối là Fe3+
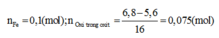
Các quá trình nhường và nhận electron:

\(GọinlàhóatrịcủaX\\ PTHH:2X+nO_2-^{t^o}\rightarrow X_2O_n\\ Tacó:n_X=2n_{X_2O_n}\\ \Rightarrow\dfrac{12,15}{X}=2.\dfrac{22,95}{2X+16n}\\ Chạynghiệmn:\\ n=1\Rightarrow X=9\\ n=2\Rightarrow18\\ n=3\Rightarrow X=27\left(chọn-Al\right)\\ \Rightarrow ChọnD\)

Kim loại không tan là Cu dư.
Cu dư => Muối thu được gồm FeCl2 và CuCl2 vì: Cu + 2FeCl3 → CuCl2 + 2FeCl2
Số mol các chất là: 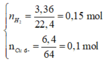
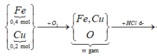
Sơ đồ phản ứng:
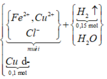
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Đáp án A.
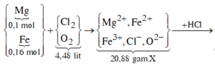
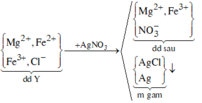
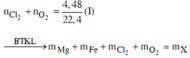
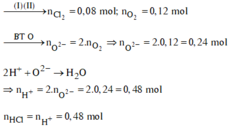
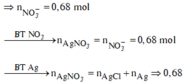

Bảo toàn Fe: nFe(bđ) = 0,012 + 0,12 + 0,01.3 + 0,01.2 = 0,182 (mol)
=> m = 0,182.56 = 10,192 (g)