Cho a g hỗn hợp Fe và FeS phản ứng với dung dịch 400g HCl 7,3% dư thu được dd A 4,48 lít hỗn hợp khí X ở đktc, tỉ khối của hỗn hợp X với hiddro là 9
a. Tính % thể tích mỗi chất trong hỗn hợp X
b. Tính a và % khối lượng mỗi chất trong hỗn hợp đầu.
c. Tính C% các chất trong dung dịch A

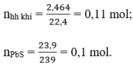
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
a 2a a a
\(FeS+2HCl\rightarrow FeCl_2+H_2S\uparrow\)
b 2b b b
\(n_{HCl}=\dfrac{400\times7.3}{100\times36.5}=0.8mol\)
\(n_X=\dfrac{4.48}{22.4}=0.2mol\)
\(M_X=2\times9=18\Leftrightarrow\dfrac{2a+34b}{a+b}=18\)
Ta có: \(\left\{{}\begin{matrix}a+b=0.2\\\dfrac{2a+34b}{a+b}=18\end{matrix}\right.\)\(\Leftrightarrow\left\{{}\begin{matrix}a+b=0.2\\2a+34b=3.6\end{matrix}\right.\)\(\Leftrightarrow\left\{{}\begin{matrix}a=0.1\\b=0.1\end{matrix}\right.\)
a. \(\%V_{H_2}=\dfrac{0.1\times22.4\times100}{4.48}=50\%\)
\(\%V_{H_2S}=100-50=50\%\)
b. \(a=0.1\times56+0.1\times88=14.4g\)
\(\%m_{Fe}=\dfrac{0.1\times56}{14.4}\times100=38.8\%\)
\(\%m_{FeS}=100-38.8=61.2\%\)
c. m dung dịch sau phản ứng\(=14.4+400-0.1\times2-0.1\times34=410.8g\)
nHCl phản ứng\(=2\times0.1+2\times0.1=0.4mol\)
nHCl dư = 0.8 - 0.4 = 0.4 mol
\(C\%_{HCldu}=\dfrac{0.4\times36.5\times100}{410.8}=3.55\%\)
\(C\%_{FeCl_2}=\dfrac{0.2\times127\times100}{410.8}=6.18\%\)